Disulfit - Disulfite
 | |
| Jména | |
|---|---|
| Název IUPAC disiřičitan[1] | |
| Systematický název IUPAC pentaoxido-1κ3Ó,2κ2Ó-disulfát (S — S) (2−)[1] | |
| Ostatní jména metabisulfitový ion pyrosulfit | |
| Identifikátory | |
3D model (JSmol ) | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
| S 2Ó2− 5 | |
| Konjugovaná kyselina | Kyselina siřičitá |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
A disulfit, běžně známý jako metabisulfit nebo pyrosulfit, je chemická sloučenina obsahující ion S
2Ó2−
5. Jedná se o bezbarvý dianion, který je primárně prodáván ve formě metabisulfit sodný nebo metabisulfit draselný. Po rozpuštění ve vodě uvolňují tyto soli hydrogensiřičitan HSO−
3 ion. Tyto soli působí rovnocenně hydrogensiřičitan sodný nebo hydrogensiřičitan draselný.[2]
Struktura
Na rozdíl od disulfát (S
2Ó2−
7), disiřičitanový ion (S
2Ó2−
5) má nesymetrickou strukturu s vazbou S-S. Oxidační stav atomu síry navázaného na 3 atomy kyslíku je +5, zatímco oxidační číslo dalšího atomu síry je +3.[3]
Anion se skládá z SO2 skupina spojená s SO3 skupina se záporným nábojem více lokalizovaným na SO3 konec. Délka vazby S – S je 2,22 Å a vzdálenosti „thionátové“ a „thionitové“ S – O jsou 1,46 a 1,50 Å.[4]
Výroba
Soli disulfitových iontů se vyrábějí dehydratací solí hydrogensiřičitan ion (HSO−
3). Když řešení hydrogensiřičitan sodný nebo hydrogensiřičitan draselný jsou odpařeny, metabisulfit sodný a metabisulfit draselný výsledek.[5]
- 2 HSO−
3 S
S
2Ó2−
5 + H2Ó
I když rovnováha leží daleko doleva, odpařením hydrogensiřičitanu se získá značné množství disulfitu.[6]
Disulfit je konjugovaná báze kyselina siřičitá (kyselina pyrosulfurous), která pochází z kyselina sírová v souladu s výše uvedenou dehydratační reakcí:
- 2 H2TAK3 → 2 HSO−
3 + 2 H+ → H2S2Ó5 + H2Ó
Disulfitový iont také vzniká přidáním oxid siřičitý do siřičitan ion:
| HSO− 3 3 + H+ TAK32− + SO2 2Ó2− 5 | 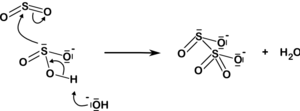 |
Použití
Disulfitové soli se používají pro konzervování potravin a nápojů.
Příklady disiřičitanů
- Metabisulfit sodný (E223 ) a disiřičitan draselný (E224) se používají jako a konzervační a antioxidant v jídle.
Reference
- ^ A b Mezinárodní unie pro čistou a aplikovanou chemii (2005). Nomenklatura anorganické chemie (Doporučení IUPAC 2005). Cambridge (Velká Británie): RSC –IUPAC. ISBN 0-85404-438-8. p. 130. Elektronická verze.
- ^ Johnstone, H.F. (1946). „Siřičitany a pyrosulfity alkalických kovů“. Anorganické syntézy. 2: 162–167. doi:10.1002 / 9780470132333.ch49. ISBN 9780470132333.
- ^ Lindqvist, I .; Mörtsell, M. "Struktura pyrosulfitu draselného a povaha pyrosulfitového iontu". Acta Crystallogr. (1957". 10: 406–409. doi:10.1107 / S0365110X57001322. Citovat deník vyžaduje
| deník =(Pomoc) - ^ K. L. Carter, T. A. Siddiquee, K. L. Murphy, D. W. Bennett „Překvapivě nepolapitelná krystalická struktura metabisulfitu sodného“ Acta Crystallogr. (2004). B60, 155–162. doi:10.1107 / S0108768104003325
- ^ Barberá, José Jiménez; Metzger, Adolf; Vlk, Manfred (2000). "Sulfity, thiosírany a dithionitová chemie". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a25_477.
- ^ Bassam Z. Shakhashiri: Chemické demonstrace: příručka pro učitele chemie University of Wisconsin Press, 1992, s. 9
