Decalin - Decalin
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Dekahydronaftalen[1] | |
| Ostatní jména Bicyklo [4.4.0] dekan[1] Decalin | |
| Identifikátory | |
3D model (JSmol ) | |
| 878165 | |
| ChEBI |
|
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.001.861 |
| Číslo ES |
|
| 185147 | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 1147 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C10H18 | |
| Molární hmotnost | 138,25 g / mol |
| Vzhled | bezbarvá kapalina |
| Hustota | 0,896 g / cm3 |
| Bod tání | trans: -30,4 ° C (-22,7 ° F, 242,7 K) cis: -42,9 ° C (-45,2 ° F, 230,3 K)[2] |
| Bod varu | trans: 187 ° C (369 ° F) cis: 196 ° C (384 ° F) |
| Nerozpustný | |
| |
Index lomu (nD) | 1.481 |
| Nebezpečí | |
| Bezpečnostní list | Bezpečnostní list Decalin |
| Piktogramy GHS |       |
| Signální slovo GHS | Nebezpečí |
| H226, H304, H314, H318, H331, H332, H400, H410, H411 | |
| P210, P233, P240, P241, P242, P243, P260, P261, P264, P271, P273, P280, P301 + 310, P301 + 330 + 331, P303 + 361 + 353, P304 + 312, P304 + 340, P305 + 351 + 338, P310, P311, P312, P321, P331, P363, P370 + 378 | |
| Bod vzplanutí | 57 ° C (135 ° F; 330 K) |
| 250 ° C (482 ° F; 523 K) | |
| Související sloučeniny | |
Související sloučeniny | Naftalen; Tetralin |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Decalin (dekahydronaftalen, také známý jako bicyklo [4.4.0] dekan a někdy dekalin),[3] A bicyklické organická sloučenina, je průmyslový solventní. Bezbarvá kapalina s aromatickým zápachem se pro mnoho lidí používá jako rozpouštědlo pryskyřice nebo přísady do paliva.[4] Je to nasycený analog naftalen a lze je z toho připravit hydrogenace v přítomnosti a katalyzátor. Dekahydronaftalen se snadno tvoří explozivní[5] organické peroxidy při skladování za přítomnosti vzduchu.[6][7]
Izomery
Dekahydronaftalen se vyskytuje v cis a trans formuláře. The trans forma je energeticky stabilnější kvůli méně sterické interakce. cis-Decalin je chirální molekula bez chirálního centra; má dvojitou osu rotační symetrie, ale žádnou reflexní symetrii. Nicméně chirality je zrušen procesem převrácení židle, který změní molekulu na zrcadlový obraz.
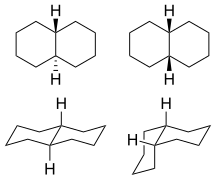
1: trans (vlevo) a cis (vpravo) izomery  2:
2:model s míčkem a hůlkou z cis- dekalin  3:
3:trans- dekalin  4:
4:cis-decalin ring-flip 
5: Polovina molekuly dekalinu: v ní cyklohexan židle konformace. Axiální polohy jsou zobrazeny červeně, zatímco polohy v rovníkové poloze jsou modré. 
6: Androstandiol, biomolekula se třemi trans kondenzované šestičlenné prsteny (a také trans fúzovaný pětičlenný jeden)
trans-Decalin
Jediný možný způsob, jak spojit dva šestičlenné kruhy v trans pozice znamená, že druhý kruh musí vycházet ze dvou rovníkových vazeb (modrého) prvního kruhu. Šestičlenný kruh nenabízí dostatečný prostor k zahájení v axiální poloze (nahoru) a dosažení axiální polohy sousedního atomu uhlíku, který pak bude na spodní straně molekuly (viz model cyklohexan na obrázku 5). Struktura je konformačně zamrzlá, spíše než mít schopnost podstoupit převrácení židle jako v cis izomer. v biologie tato fixace je široce používána v steroid kostra postavit molekuly (například obrázek 6), které hrají klíčovou roli v signalizaci mezi vzdáleně oddělenými buňkami.
Reakce
Okysličení dekalinu dává terciární hydroperoxid, který přeskupuje na cyklodecenon, předchůdce kyselina sebaková.[8]
Viz také
Reference
- ^ A b Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. str. 33, 394, 601. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Haynes, William M. (2010). Příručka chemie a fyziky (91 ed.). Boca Raton, Florida, USA: CRC Press. p. 3-134. ISBN 978-1-43982077-3.
- ^ „Dictionary.com“.
- ^ „Přísada do paliva“. Archivovány od originál dne 12. 3. 2009.
- ^ „PDF - Náhradní studie leteckého paliva JP-8 - Alessandro Agosta Thesis Drexel University“ (PDF). Archivovány od originál (PDF) dne 19. 06. 2010.
- ^ „Data Inchem.org“.
- ^ "Bezpečnostní list - JT Baker".
- ^ Griesbaum, Karl; Behr, Arno; Biedenkapp, Dieter; Voges, Heinz-Werner; Garbe, Dorothea; Paetz, Christian; Collin, Gerd; Mayer, Dieter; Höke (2000). „Uhlovodíky“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a13_227.






