Převrácení DNA báze - DNA base flipping - Wikipedia
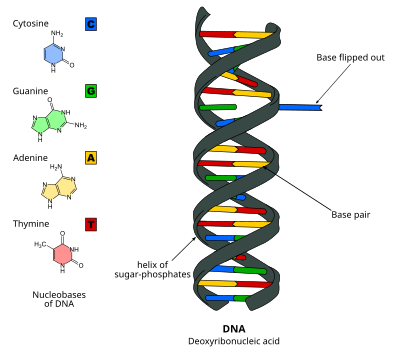
Převrácení DNA bázenebo převrácení nukleotidů, je mechanismus, ve kterém jediný nukleotid základna, nebo nukleobáze, se otáčí mimo dvojšroubovice nukleové kyseliny.[1] K tomu dochází při zpracování nukleové kyseliny enzym potřebuje přístup k základně, aby na ní mohla provádět práce, jako je například její vyříznutí pro nahrazení jinou základnou během Oprava DNA. Poprvé to bylo pozorováno v roce 1994 pomocí Rentgenová krystalografie v methyltransferáza enzymová katalyzující methylace a cytosin báze v DNA. Od té doby se ukázalo, že je používán různými enzymy v mnoha biologických procesech, jako je Methylace DNA, rozličný Oprava DNA mechanismy a replikace DNA. Může se také vyskytovat v dvojitých šroubovicích RNA [2] nebo v meziproduktech DNA: RNA vytvořených během Transkripce RNA.
K převrácení báze DNA dochází rozbitím Vodíkové vazby mezi základnami a rozbalením základny od sousedů. K tomu může dojít aktivním procesem, kdy se enzym váže na DNA a poté usnadňuje rotaci báze, nebo pasivním procesem, kdy se báze spontánně otáčí a tento stav je rozpoznán a vázán enzymem. Lze jej detekovat pomocí Rentgenová krystalografie, NMR spektroskopie, fluorescenční spektroskopie nebo hybridizační sondy.
Objev
Převrácení základny bylo poprvé pozorováno v roce 1994, kdy použili vědci Klimasauskas, Kumar, Roberts a Cheng Rentgenová krystalografie zobrazit mezikrok v chemické reakci a methyltransferáza vázán DNA.[3] Methyltransferázou, kterou použili, byla methyltransferáza C5-cytosinu Haemophilus haemolyticus (M.HhaI). Tento enzym rozpoznává specifickou sekvenci DNA (5'-GCGC-3 ') a první methyláty cytosin základny sekvence na jejím místě C5.[3] Po krystalizaci komplexu M. Hhal-DNA zjistili, že cílová cytosinová báze byla zcela otočena z dvojité šroubovice a byla umístěna v aktivním místě M. Hhal. Byl udržován na místě četnými interakcemi mezi M. HhaI a DNA.[3]
Autoři se domnívali, že převrácení báze je mechanismus používaný mnoha jinými enzymy, jako je helikázy, rekombinace enzymy, RNA polymerázy, DNA polymerázy, a Topoizomerázy typu II.[3] V letech následujících po tomto objevu bylo provedeno mnoho výzkumů a bylo zjištěno, že převrácení základny je mechanismus používaný v mnoha biologických procesech, které autoři navrhují.[4][5][6]
Mechanismus
DNA nukleotidy jsou drženy pohromadě s Vodíkové vazby, které jsou relativně slabé a lze je snadno rozbít. K převrácení základny dochází v milisekundovém časovém měřítku[7] rozbitím vodíkových vazeb mezi bázemi a rozbalením báze od jejích sousedů.[8] Základna je otočena z dvojitá spirála o 180 stupňů.,[9] obvykle prostřednictvím hlavní drážka,[10] a do aktivního místa enzymu. Toto otevření vede k malým konformačním změnám v páteři DNA[11] které se rychle stabilizují zvýšenými interakcemi enzym-DNA.[12] Studie zaměřené na energie zdarma profily převrácení základny ukázaly, že bariéra volné energie proti převrácení může být snížena o 17 kcal / mol pro M.HhaI v zavřeném stavu konformace.[10]
Existují dva mechanismy převrácení DNA báze: aktivní a pasivní.[13] V aktivním mechanismu se enzym váže na DNA a poté aktivně otáčí bází, zatímco v pasivním mechanismu se poškozená báze nejprve spontánně otáčí, poté je rozpoznána a vázána enzymem.[8] Výzkum prokázal oba mechanismy: uracil-DNA glykosyláza následuje pasivní mechanismus[8] a Tn10 transposáza následuje aktivní mechanismus.[14]
Studie dále ukázaly, že převrácení báze DNA je používáno mnoha různými enzymy v různých biologických procesech, jako je např Methylace DNA, rozličný Oprava DNA mechanismy, Transkripce RNA a replikace DNA.[4][5][6]
Biologické procesy
Modifikace a opravy DNA
DNA může mít mutace které způsobují poškození báze ve vlákně DNA. Aby byla zajištěna genetická integrita DNA, musí enzymy opravit jakékoli poškození. Existuje mnoho druhů Oprava DNA. Oprava základní excize využívá převrácení základny k vyklopení poškozené základny z dvojité šroubovice[5] a do kapsy specifičnosti a glykosyláza který hydrolyzuje glykosidovou vazbu a odstraňuje bázi.[15] DNA glykosylázy interagují s DNA a převracejí báze, aby určily nesoulad. Příklad opravy excize báze nastává, když je cytosinová báze deaminována a stává se z ní báze uracilu. To způsobí chybný pár U: G, který je detekován Uracil DNA glykosyláza. Základ uracilu je vyklopen do aktivní kapsy glykosylázy, kde je odstraněn z řetězce DNA.[16] Překlopení základny se používá k opravě mutací, jako je 8-oxoguanin (oxoG)[17] a dimery tyminu vytvořené UV zářením.[15][18]
Replikace, transkripce a rekombinace
replikace DNA a Transkripce RNA oba využívají převrácení základny.[5] DNA polymeráza je enzym, který provádí replikaci. Lze to považovat za ruku, která svírá DNA jednovláknovou šablonu.[15] Když templát prochází přes palmovou oblast polymerázy, báze templátu se vyklopí ze šroubovice a pryč od dNTP vazebné místo.[19] Během přepisu RNA polymeráza katalyzuje syntézu RNA. Během zahájení fáze, dvě základny v -10 prvků vyklopte ze spirály a do dvou kapes v RNA polymeráze. Tyto nové interakce stabilizují prvek -10 a podporují oddělení nebo roztavení řetězců DNA.[15][20]
K převrácení základny dochází během pozdějších fází rekombinace.[21] RecA je protein, který podporuje invaze pramenů[15] v době homologní rekombinace. Překlopení základny bylo navrženo jako mechanismus, kterým RecA může umožnit rozpoznání jednoho řetězce homologie v duplexní DNA.[22] Další studie naznačují, že se také podílí na V (D) J rekombinace.[23]
Methylace DNA

Methylace DNA je proces, ve kterém a methylová skupina je přidán do a cytosin nebo adenin.[24] Tento proces způsobí aktivaci nebo deaktivaci genová exprese, což vede k regulaci genů v eukaryotických buňkách. Je také známo, že proces methylace DNA je zapojen do určitých typů rakovina formace.[25][26][27] Aby k této chemické modifikaci došlo, je nutné, aby cílová báze vyklouzla z dvojité šroubovice DNA, aby umožnila methyltransferasám katalyzovat reakci.[5]
Rozpoznání cíle restrikčními endonukleázami
Restrikční endonukleázy, také známé jako restrikční enzymy jsou enzymy, které štěpí páteřní cukr-fosfát DNA na konkrétní nukleotidy sekvence, které jsou obvykle čtyři až šest nukleotidů dlouhé.[28] Studie provedené Hortonem a kolegy ukázaly, že mechanismus, kterým tyto enzymy štěpí DNA, zahrnuje převrácení báze, ohýbání DNA a expanzi malá drážka.[29] V roce 2006 Horton a jeho kolegové rentgenová krystalografie byly předloženy důkazy ukazující, že restrikční endonukleáza HinP11 využívá převrácení báze k rozpoznání své cílové sekvence. Tento enzym je známo, že štěpí DNA na palindromický tetranukleotidová sekvence G ↓ CGC.
Experimentální přístupy k detekci
Rentgenová krystalografie
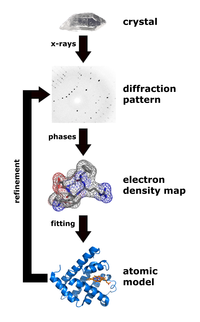
Rentgenová krystalografie je technika, která měří úhly a intenzitu krystalické atomy za účelem stanovení atomové a molekulární struktury sledovaného krystalu. Krystalografové jsou pak schopni vytvářet trojrozměrný obraz, kde jsou polohy atomy, chemické vazby stejně jako další důležité vlastnosti lze určit.[30] Klimasaukas a kolegové použili tuto techniku k pozorování prvního fenoménu převrácení základny, ve kterém jejich experimentální postup zahrnoval několik kroků:[3]
- Čištění
- Krystalizace
- Sběr dat
- Stanovení struktury a zdokonalení
Během čištění Haemophilus haemolyticus methyltransferáza byl nadměrně vyjádřený a purifikovány pomocí kroku zpětné extrakce s vysokým obsahem soli k selektivní solubilizaci M.HhaI, následované rychlou proteinovou kapalinovou chromatografií (FPLC ), jak již dříve provedli Kumar a kolegové.[31] Autoři využili aniontový výměnný sloupec Mono-Q k odstranění malého množství bílkovinné materiály a nežádoucí DNA před krokem krystalizace. Jakmile byl M.HhaI úspěšně purifikován, byl vzorek poté pěstován pomocí metody, která míchá roztok obsahující komplex při teplotě 16 ° C a technikou difúze par visícími kapkami za získání krystalů. Autoři pak byli schopni sbírat rentgenová data podle techniky používané Chengem a kolegy v roce 1993.[32] Tato technika zahrnovala měření difrakčních intenzit na FAST detektoru, kde byly doby expozice pro rotaci 0,1 ° 5 nebo 10 sekund. Klimasaukas a kolegové pro určení a zdokonalení struktury použili molekulární náhradu rafinované apo struktury popsané Chengem a kolegy v roce 1993[32] kde jsou vyhledávací modely X-PLOR, MERLOT, a TRNSUM byly použity k řešení rotačních a překladových funkcí.[33][34] Tato část studie zahrnuje použití různých softwarových a počítačových algoritmů k řešení struktur a charakteristik sledovaného krystalu.
NMR spektroskopie
NMR spektroskopie je technika, která se v průběhu let používala ke studiu důležitých dynamických aspektů převrácení základny. Tato technika umožňuje vědcům určit fyzikální a chemické vlastnosti atomy a další molekuly využitím magnetických vlastností atomová jádra.[35] Kromě toho může NMR poskytnout celou řadu informací včetně struktury, reakční stavy, chemické prostředí molekul a dynamika.[36][37] Během objevovacího experimentu převrácení báze DNA vědci využili NMR spektroskopii ke zkoumání převrácení báze indukované enzymem HhaI methyltransferázy. Aby bylo možné provést tento experiment, dva 5-fluorcytosin zbytky byly začleněny do cíle a referenční polohy s DNA substrátem tak, aby 19Lze provést analýzu chemického posunu. Jednou 19F byla vyhodnocena analýza chemického posunu, poté se dospělo k závěru, že komplexy DNA existovaly s více formami cílového 5-fluorocytosinu podél převrácené dráhy.[38]
Fluorescenční spektroskopie
Fluorescenční spektroskopie je technika, která se používá k rozboru vzorku pomocí fluorescenční sondy. Samotné DNA nukleotidy nejsou vhodnými kandidáty na tuto techniku, protože při světelné excitaci snadno znovu nevyzařují světlo.[39] K detekci převrácení báze je nutný fluorescenční marker. 2-Aminopurin je základna, která je strukturálně podobná adenin, ale je velmi fluorescenční, když je vyklopen z duplexu DNA.[40] Běžně se používá k detekci převrácení báze a má excitaci při 305–320 nm a emisi při 370 nm, takže se dobře odděluje od excitací proteinů a DNA. Jiné fluorescenční sondy používané ke studiu převrácení DNA báze jsou 6MAP (4 ‑ amino ‑ 6 ‑ methyl ‑ 7 (8H) -pteridon)[41] a Pyrrolo ‑ C (3- [p-D-2-ribofuranosyl] -6-methylpyrrolo [2,3-d] pyrimidin-2 (3H) -on).[42][43] Časově rozlišená fluorescenční spektroskopie se také používá k poskytnutí podrobnějšího obrazu rozsahu převrácení základny, jakož i konformační dynamiky vyskytující se při převrácení základny.[44]
Hybridizační sondování
Hybridizační sondy lze použít k detekci převrácení základny. Tato technika používá molekulu, která má komplementární sekvenci k sekvenci, kterou byste chtěli detekovat, takže se váže na jednořetězce DNA nebo RNA. K detekci převrácení báze bylo použito několik hybridizačních sond. Manganistan draselný se používá k detekci tymin zbytky, které byly vyhozeny cytosin-C5 a adenin-N6 methyltransferázy.[45] Chloracetaldehyd se používá k detekci cytosin zbytky vyklopené Hhal DNA cytosin-5 methyltransferázou (M. Hhal).[46]

Viz také
- Oprava DNA
- Oprava základní excize
- replikace DNA
- Transkripce RNA
- Methylace DNA
- DNA methyltransferáza
- Genetická rekombinace
- Homologní rekombinace
- DNA
- Epigenetika
- Epigenomika
Reference
- ^ Roberts, RJ; Cheng, X (1998). "Překlopení základny". Roční přehled biochemie. 67 (1): 181–198. doi:10.1146 / annurev.biochem.67.1.181. PMID 9759487.
- ^ Reiter, NJ; Blad, H; Abildgaard, F; Butcher, SE (2004). "Dynamika v U6 RNA intramolekulární kmenové smyčce: základní převrácení konformační změny". Biochemie. 43 (43): 13739–47. doi:10.1021 / bi048815y. PMID 15504036. S2CID 25391616.
- ^ A b C d E Klimasauskas, Saulius; Kumar, Sanjay; Roberts, Richard J .; Cheng, Xiaodong (leden 1994). „Hhal methyltransferáza vyletí svou cílovou základnu ze šroubovice DNA“. Buňka. 76 (2): 357–369. doi:10.1016/0092-8674(94)90342-5. PMID 8293469.
- ^ A b Brown, Tom. "Kniha nukleových kyselin". Citováno 26. února 2014.
- ^ A b C d E Huang, Niu; Nilesh K. Banavali; Alexander D. MacKerell (7. ledna 2003). „Převrácení báze usnadněné proteinem v DNA cytosin-5-methyltransferázou“. PNAS. 100 (1): 68–73. Bibcode:2003PNAS..100 ... 68H. doi:10.1073 / pnas.0135427100. PMC 140885. PMID 12506195.
- ^ A b Grubmüller, Helmut. „Převrácení DNA základny“. Citováno 26. února 2014.
- ^ Bouvier, Benjamin; Grubmüller, Helmut (srpen 2007). „Studie molekulární dynamiky pomalého převrácení báze v DNA pomocí konformačního zaplavení“ (PDF). Biofyzikální deník. 93 (3): 770–786. Bibcode:2007BpJ .... 93..770B. doi:10.1529 / biophysj.106.091751. PMC 1913169. PMID 17496048.
- ^ A b C Lariviere, L. (23. června 2004). „Strukturální důkazy pasivního mechanismu převrácení báze pro glukosyltransferázu“. Journal of Biological Chemistry. 279 (33): 34715–34720. doi:10,1074 / jbc.M404394200. PMID 15178685.
- ^ Grosjean, [editoval] Henri (2009). Enzymy modifikace DNA a RNA: struktura, mechanismus, funkce a evoluce. Austin, Tex.: Landes Bioscience. ISBN 978-1-58706-329-9. Archivovány od originál dne 2014-04-07. Citováno 2014-03-10.CS1 maint: další text: seznam autorů (odkaz)
- ^ A b Huang, N .; Banavali, N. K.; MacKerell, A. D. (27. prosince 2002). „Převrácení báze usnadněné proteinem v DNA cytosin-5-methyltransferázou“. Sborník Národní akademie věd. 100 (1): 68–73. doi:10.1073 / pnas.0135427100. PMC 140885. PMID 12506195.
- ^ Giudice, E. (1. března 2003). „Otevření párů bází v B-DNA: dráhy volné energie pro páry GC a AT ze simulací vzorkování deštníku“. Výzkum nukleových kyselin. 31 (5): 1434–1443. doi:10.1093 / nar / gkg239. PMC 149832. PMID 12595551. Citováno 15. března 2014.
- ^ Huang, N .; Banavali, N. K.; MacKerell, A. D. (27. prosince 2002). „Převrácení báze usnadněné proteinem v DNA cytosin-5-methyltransferázou“. Sborník Národní akademie věd. 100 (1): 68–73. doi:10.1073 / pnas.0135427100. PMC 140885. PMID 12506195.
- ^ O'Neil, Lauren. Překlopení základny v DNA: Detekce, struktury a energetika, disertační práce. ISBN 9780549590743. Citováno 15. března 2014.
- ^ Bischerour, Julien; Chalmers, Ronald; Bielinsky, Anja-Katrin (10. července 2009). „Převrácení základny v transpozici Tn10: Aktivní mechanismus převrácení a zachycení“. PLOS ONE. 4 (7): e6201. Bibcode:2009PLoSO ... 4.6201B. doi:10.1371 / journal.pone.0006201. PMC 2705183. PMID 19593448.
- ^ A b C d E University, James D. Watson, Cold Spring Harbor Laboratory, Tania A. Baker, Massachusetts Institute of Technology, Alexander Gann, Cold Spring Harbor Laboratory, Michael Levine, University of California, Berkeley, Richard Losik, Harvard (2014). Molekulární biologie genu (Sedmé vydání). Boston: Pearson / CSH Press. ISBN 978-0-321-76243-6.
- ^ Krokan, Hans E; Drabløs, Finn; Slupphaug, Geir (16. prosince 2002). "Uracil v DNA - výskyt, důsledky a oprava". Onkogen. 21 (58): 8935–8948. doi:10.1038 / sj.onc.1205996. PMID 12483510.
- ^ Banerjee, Anirban; Yang, Wei; Karplus, Martin; Verdine, Gregory L. (31. března 2005). "Struktura opravného enzymu vyšetřujícího nepoškozenou DNA objasňuje rozpoznání poškozené DNA". Příroda. 434 (7033): 612–618. Bibcode:2005 Natur.434..612B. doi:10.1038 / nature03458. PMID 15800616.
- ^ Fuxreiter, Monika; Luo, Ning; Jedlovszky, Pál; Simon, István; Osman, Roman (listopad 2002). "Role převrácení báze při specifickém rozpoznání poškozené DNA opravnými enzymy". Journal of Molecular Biology. 323 (5): 823–834. doi:10.1016 / S0022-2836 (02) 00999-3. PMID 12417196.
- ^ Patel, Premal H .; Suzuki, Motoshi; Adman, Elinor; Shinkai, Akeo; Loeb, Lawrence A. (květen 2001). „Prokaryotic DNA polymerase I: evolution, structure, and„ base flipping “mechanism for nucleotide selection“. Journal of Molecular Biology. 308 (5): 823–837. doi:10.1006 / jmbi.2001.4619. PMID 11352575. S2CID 16277925.
- ^ Lim, H. M .; Lee, H. J .; Roy, S .; Adhya, S. (4. prosince 2001). „„ Master “v párování báze během izomerizace promotoru po navázání RNA polymerázy“. Sborník Národní akademie věd. 98 (26): 14849–14852. Bibcode:2001PNAS ... 9814849L. doi:10.1073 / pnas.261517398. PMC 64947. PMID 11734629.
- ^ Voloshin, Oleg N .; Camerini-Otero, R. Daniel (září 2004). „Synaptický komplex se vrátil“. Molekulární buňka. 15 (6): 846–847. doi:10.1016 / j.molcel.2004.09.010. PMID 15383274.
- ^ Folta-Stogniew, E; O'Malley, S; Gupta, R; Anderson, KS; Radding, CM (24. září 2004). „Výměna párů bází DNA, která se shoduje s rozpoznáním homologie podporované proteinem RecA E. coli“. Molekulární buňka. 15 (6): 965–75. doi:10.1016 / j.molcel.2004.08.017. PMID 15383285.
- ^ Bischerour, J .; Lu, C .; Roth, D. B .; Chalmers, R. (31. srpna 2009). „Překlopení základny v rekombinaci V (D) J: Pohled do mechanismu formování vlásenky, pravidla 12/23 a koordinace dvojitých pramenů“. Molekulární a buněčná biologie. 29 (21): 5889–5899. doi:10.1128 / MCB.00187-09. PMC 2772739. PMID 19720743.
- ^ Klose, Robert J .; Adrian P. Bird (2006). „Methylace genomové DNA: značka a její mediátoři“. Trendy v biochemických vědách. 31 (2): 89–97. doi:10.1016 / j.tibs.2005.12.008. ISSN 0968-0004. PMID 16403636.
- ^ Nakao, M (2001). "Epigenetika: Interakce methylace DNA a chromatinu". Gen. 278 (1–2): 25–31. doi:10.1016 / s0378-1119 (01) 00721-1. PMID 11707319.
- ^ Plass, C; Soloway, PD (2002). „Methylace DNA, otisk a rakovina“. Eur J Hum Genet. 10 (1): 6–16. doi:10.1038 / sj.ejhg.5200768. PMID 11896451.
- ^ Esteller, M; Herman, JG (2002). „Rakovina jako epigenetická nemoc: methylace DNA a změny chromatinu v lidských nádorech“. J Pathol. 196 (1): 1–7. doi:10,1002 / cesta 1024. PMID 11748635.
- ^ „Archivovaná kopie“. Archivovány od originál dne 2014-04-18. Citováno 2014-04-03.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ Horton, John R .; Zhang, Xing; Maunus, Robert; Yang, Zhe; Wilson, Geoffrey; Roberts, Richard; Cheng, Xiaodong (2006). „DNA Nicking by HinP1I Endonuclease: Bending, Base Flipping and Minor Groove Expansion“. Výzkum nukleových kyselin. 34 (3): 939–948. doi:10.1093 / nar / gkj484. PMC 1363774. PMID 16473850.
- ^ Rentgenová krystalografie
- ^ Kumar, S; Cheng, X; Pflugrath, JW; Roberts, RJ (1992). "Čištění, krystalizace a předběžná rentgenová difrakční analýza komplexu M.HhaI-AdoMet". Biochemie. 31 (36): 8648–8653. doi:10.1021 / bi00151a035. PMID 1390649.
- ^ A b Cheng, X; Kumar, S; Posfai, J; Pflugrath, JW; Roberts, RJ (1993). "Krystalová struktura HhaI DNA methyltransferázy v komplexu s S-adenosyl-L-methioninem". Buňka. 74 (2): 299–307. doi:10.1016 / 0092-8674 (93) 90421-l. PMID 8343957.
- ^ Brunger A.T. (1992) „X-PLOR, verze 3.1: Systém pro rentgenovou krystalografii a NMR“ (New Haven, Connecticut: Yale University Press)
- ^ Fitzgerald, P.M.D. (1988). „MERLOT, integrální balíček počítačových programů pro stanovení krystalové struktury molekulární náhradou“. J. Appl. Crystallogr. 21 (3): 273–288. doi:10.1107 / s0021889887012299.
- ^ NMR spektroskopie
- ^ Gueron, M. a J. L. Leroy. 1995. Studium kinetiky základních párů pomocí NMR měření výměny protonů. V nukleární magnetické rezonanci a nukleových kyselinách. Academic Press, San Diego, CA.
- ^ Leijon, M .; Graslund, A. (1992). "Účinky sekvence a délky na kinetiku imino protonové výměny a otevírání bazických párů v DNA oligonukleotidových duplexech". Nucleic Acids Res. 20 (20): 5339–5343. doi:10.1093 / nar / 20.20.5339. PMC 334339. PMID 1331987.
- ^ Klimasaukas, Salius a Zita Liutkeviciute. „Experimentální přístupy ke studiu převrácení DNA báze.“ Enzymy modifikace DNA a RNA: struktura, mechanismus, funkce a evoluce. Landes Bioscience, 2009. 37-50. Web. 16. března 2014. <https://www.landesbioscience.com/pdf/04GrosjeanKlimasauskas.pdf Archivováno 07.04.2014 na Wayback Machine >.
- ^ Grosjean, [editoval] Henri (2009). Enzymy modifikace DNA a RNA: struktura, mechanismus, funkce a evoluce (PDF). Austin, Tex.: Landes Bioscience. str. 43. ISBN 978-1-58706-329-9.CS1 maint: další text: seznam autorů (odkaz)
- ^ Holz, B (15. února 1998). „2-Aminopurin jako fluorescenční sonda pro převrácení báze DNA methyltransferázami“. Výzkum nukleových kyselin. 26 (4): 1076–1083. doi:10.1093 / nar / 26.4.1076. PMC 147370. PMID 9461471.
- ^ Yang, K; Matsika, S; Stanley, RJ (6. září 2007). „6MAP, analog fluorescenčního adeninu, je sonda převrácení báze pomocí DNA fotolyázy“. The Journal of Physical Chemistry B. 111 (35): 10615–25. doi:10.1021 / jp071035p. PMID 17696385. S2CID 4998287.
- ^ Yang, K; Stanley, RJ (květen - červen 2008). „Rozsah deformace DNA v komplexech DNA fotolyáza-substrát: studie stavu fluorescence v roztoku“. Fotochemie a fotobiologie. 84 (3): 741–9. doi:10.1111 / j.1751-1097.2007.00251.x. PMID 18086248.
- ^ Berry, David A .; Jung, Kee-Yong; Wise, Dean S .; Sercel, Anthony D .; Pearson, William H .; Mackie, Hugh; Randolph, John B .; Somers, Robert L. (březen 2004). „Pyrrolo-dC a pyrrolo-C: fluorescenční analogy cytidinu a 2′-deoxycytidinu pro studium oligonukleotidů“. Čtyřstěn dopisy. 45 (11): 2457–2461. doi:10.1016 / j.tetlet.2004.01.108.
- ^ Neely, R. K.; Tamulaitis, G .; Chen, K .; Kubala, M .; Siksnys, V .; Jones, A. C. (8. září 2009). „Časově rozlišené fluorescenční studie převrácení nukleotidů restrikčními enzymy“. Výzkum nukleových kyselin. 37 (20): 6859–6870. doi:10.1093 / nar / gkp688. PMC 2777440. PMID 19740769.
- ^ Serva, S (1. srpna 1998). „Chemické zobrazení zbytků thyminu vyřazených DNA methyltransferázami“. Výzkum nukleových kyselin. 26 (15): 3473–3479. doi:10.1093 / nar / 26.15.3473. PMC 147733. PMID 9671807.
- ^ Daujotyte, D .; Liutkeviciute, Z .; Tamulaitis, G .; Klimasauskas, S. (15. dubna 2008). „Chemické mapování cytosinů enzymaticky vyklouzlo ze spirály DNA“. Výzkum nukleových kyselin. 36 (10): e57. doi:10.1093 / nar / gkn200. PMC 2425465. PMID 18450817.
