Bispidin - Bispidine
 | |
| Jména | |
|---|---|
| Název IUPAC 3,7-diazabicyklo [3.3.1] nonan | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEMBL | |
| ChemSpider | |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C7H14N2 | |
| Molární hmotnost | 126,203 g / mol |
| Bod tání | 158-161 ° C |
| Bod varu | 190-195 ° C (9 torrů) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
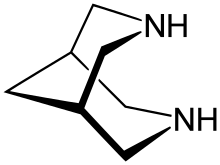
Bispidin (3,7-diazabicyklo [3.3.1] nonan) je organická sloučenina který je klasifikován jako bicyklický diamin. I když je syntetický, strukturálně souvisí s přírodním alkaloid spartein. Je to bílá krystalická pevná látka. Bylo široce vyšetřováno jako chelatační činidlo. Je známo mnoho derivátů.
Struktura a stereochemie
Bispidin má a bicyklické lešení skládající se ze dvou kondenzovaných piperidiny. Nesubstituovaná bispidinová páteř může mít tři konformace: a židle-židle, křeslo na lodi a člun na lodi. V plynné fázi je židle-židle převládá konformace[1]
Syntéza
Vhodný způsob syntézy molekuly bispidinu zahrnuje pent-1-en-3-on a prop-2-en-1-amin vedoucí k bis (karbethoxyethyl) allylaminu, který se převádí na 1-allylpiperidin-4-on kyselá hydrolýza a dekarboxylace. Pak Mannichova reakce dochází, zejména a kondenzace a 4-piperidon derivát s paraformaldehydem a allylaminem v přítomnosti octová kyselina tvoří N, N'-diallylbispidin-9-on. Výsledkem tohoto je konečný bispidin po ošetření ethylchlorformiát v přítomnosti NaI, následován alkalická hydrolýza.[2]

Reakce
Reakcí s formaldehydem se získá diazaadamantan.[3]

Bispidinové ligandy
Bispidinová jednotka může být chemicky funkcionalizována v několika polohách svého rigidního bicyklického skeletu, což vede k velkému počtu ligandů bispidinového typu.[4]
Syntéza
První ligandy založené na bispidinu se datují do roku 1930, kdy Carl Mannich uvádí syntézu dvou různých substituovaných molekul bispidinu.[5]Běžnou cestou k získání derivátů bispidinu je variace Mannichovy reakce, ke získání konečného produktu jsou nutné zejména dva kroky. První krok zahrnuje reakci mezi sloučeninou obsahujícími kyselé vodíky C-H, an aldehyd a primární amin pomocí předdefinovaného molární poměr 1: 2: 1, což vede k piperidonu. Dále došlo ke druhé kondenzaci mezi piperidonem, an alifatický aldehyd a primární amin, za použití poměru 1: 4: 2, získá požadovaný bispidin. Je nutné kontrolovat reakční podmínky, aby se zabránilo konkurenci aldolová reakce.[6] Ve skutečnosti by měl být reakční roztok co nejvíce koncentrovaný, aby poskytl maximální výtěžek, s použitím alkoholů, THF nebo jiných rozpouštědel uvedených v literatuře. Zatímco pro jednostupňovou kondenzaci jsou výhodné vysoké teploty, dvoustupňová reakce se obvykle provádí při 0 ° C pro první a refluxní během druhé.

Stereochemie
Chemické substituce na základním řetězci bispidinu mohou ovlivnit rovnováhu konformérů. Mnoho výpočetních studií a dalších založených na nukleární magnetická rezonance (1H a 13C NMR), Rentgenová krystalografie a Ramanova spektroskopie byly provedeny pro zkoumání různých konformačních entit derivátů bispidinu.[7]
Koordinační chemie
Ligandy na bázi bispidinu se většinou používají v koordinační chemie.[4] První přechodový kov komplex s bidentátním bispidinem pochází z roku 1957.[8] Přidáním dalších vazebných míst na kov v základním bispidinovém lešení, které již má dva alifatické aminické atomy N donoru, je efektivní stabilní kovové komplexy lze selektivně syntetizovat, čímž se získá tetra-,[9] penta-,[10] hexa-[11] a okta[12] zubaté druhy.
Potenciální aplikace
Kvůli chemické univerzálnosti bispidinové kostry a kvůli kovové selektivitě a stabilitě komplexů tohoto typu ligandu byly navrženy pro mnoho aplikací, ačkoli žádná nebyla komerčně dostupná
Katalýza
Cu (II) -bispidinové komplexy katalyzují aziridace.[13]Aminokyseliny modifikovaná bispidinová základní struktura podporuje katalyzátory pro enantio-selektivní aldolovou reakci funkcionalizovaných ketony.[14] Byly zkoumány komplexy železa na bázi bispidinu oxidace z olefin a neaktivované vazby CH.[15]
Farmaceutické použití
Několik patentů se týká použití bispidinových ligandů pro jejich použití antiarytmické[16] a analgetická aktivita.[17] Bylo také zjištěno, že vykazují vysokou afinitu a selektivitu k ĸ-opioidní receptory a také bylo popsáno mnoho studií týkajících se vlivu strukturálních variací na jejich biologickou aktivitu.[18]
Lék
Bifidinové systémy byly také použity jako bifunkční chelátory pro PET zkoušky.[19] Mezi tyto požadavky patří rychlá komplexace, dostupnost různých funkcí pro propojení s cílovými vektory a nákladově efektivní způsob jejich syntézy v multigramovém měřítku. Byla provedena funkcionalizace a optimalizace pentadentátových derivátů bispidinu a vyhodnocení potenciálu komplexů radio-měď-bispidin jako stopovacích látek PET.
jiný
Deriváty bispidinu byly použity jako ligandy pro konstrukci nových jednorozměrných koordinační polymery, což ukazuje zajímavý vliv na dynamické chování těchto hybridních systémů.[20]
Reference
- ^ Mastryukov, V.S .; Osina, E. L .; Dorofeeva, O. V .; Popik, M. V .; Vilkov, L. V .; Belikova, N. A. (1979). "Studie elektronové difrakce molekulární struktury plynného bicyklo [3.3.1] nonanu". J. Mol. Struct. 52 (1): 211–224. Bibcode:1979JMoSt..52..211M. doi:10.1016/0022-2860(79)80119-2.
- ^ Miyahara, Y .; Goto, K .; Inazu, T. (2001). "Pohodlná syntéza 3,7-diazabicyklo [3.3.1] nonanu (bispidinu)". Syntéza. 2001 (3): 364–366. doi:10.1055 / s-2001-11427.
- ^ Galinovsky, F .; Langer, H. (1955). „Synthese des 1,3-Diaza-adamantans und des Bispidins“. Monatshefte für Chemie. 86 (3): 449–453. doi:10.1007 / BF00903631.
- ^ A b Comba, P .; Kerscher, M .; Schiek, W. (2005). "Bispidinová koordinační chemie". Pokrok v anorganické chemii. 55 (Kapitola 9): 613–704. doi:10.1002 / 9780470144428.ch9.
- ^ Mannich, C .; Mohs, P. (1930). „Über Derivate eines aus zwei Piperidinringen kondensierten bicyclischen Systems“. Chem. Ber. 63 (3): 608–612. doi:10.1002 / cber.19300630314.
- ^ Holzgrabe, U .; Ericyas, E. (1992). „Synthese und Stereochemie potentiell stark analgetischer 2,4 ‐ m ‐ diarylsubstituierter 3,7 ‐ Diazabicyclo [3.3.1] nonan ‐ 9 ‐ on ‐ 1,5 ‐ diester“. Archiv der Pharmazie. 325 (10): 657–663. doi:10.1002 / ardp.19923251008. PMID 1334646.
- ^ Jeyaraman, R .; Avila, S. (1981). „Chemistry of 3-Azabicyclo [3.3.1] nonanes“. Chemické recenze. 81 (2): 149–174. doi:10.1021 / cr00042a002.
- ^ Stetter, H .; Merten, R. (1957). „Über Verbindungen mit Urotropin ‐ Struktur, IX. Zur Kenntnis des Bispidins“. Chem. Ber. 90 (6): 868–875. doi:10.1002 / cber.19570900605.
- ^ Comba, P .; Kanellakopulos, B .; Katsichtis, C .; Lienke, A .; Pritzkow, H .; Rominger, F. (1998). "Syntéza a charakterizace sloučenin manganu (II) s tetradentátovými ligandy na základě bispidinové základní skupiny". Journal of the Chemical Society, Dalton Transactions (23): 3997–4002. doi:10.1039 / A805944F.
- ^ Comba, P .; Kerscher, M .; Lawrance, GA; Martin, B .; Wadepohl, H .; Wunderlich, S. (2008). „Stabilní komplexy kobaltu (III) s pěti a šesti souřadnicemi s ligandem bispidinu pentadentátu †“. Angew. Chem. Int. Vyd. 47 (25): 4740–4743. doi:10.1002 / anie.200800515. PMID 18484579.
- ^ Bleiholder, C .; Börzel, H .; Comba, P .; Ferrari, R .; Heydt, M .; Kerscher, M .; Kuwata, S .; Laurenczy, G .; Lawrance, GA; Lienke, A .; Martin, B .; Merz, M .; Nuber, B .; Pritzkow, H. (2005). „Coordination Chemistry of a New Rigid, Hexadentate Bispidine-Based Bis (amine) tetrakis (pyridine) Ligand“. Inorg. Chem. 44 (22): 8145–8155. doi:10.1021 / ic0513383. PMID 16241165.
- ^ Comba, P .; Jermilova, U .; Orvig, C .; Patrick, B.O .; Ramogida, C.F .; Reck, K .; Schneider, C .; Starke, M. (2017). „Octadentate Bispidine Ligand na bázi kyseliny pikolinové pro ionty radiometalu“. Chem. Eur. J. 23 (63): 15945–15956. doi:10.1002 / chem.201702284. PMID 28815804.
- ^ Comba, P .; Merz, M .; Pritzkow, H. (2003). „Katalytická aziridace styrenu s měděnými komplexy substituovaných 3,7-diazabicyklo [3.3.1] nonanonů.“ Eur. J. Inorg. Chem. 2003 (9): 1711–1718. doi:10.1002 / ejic.200200618.
- ^ Liu, J .; Yang, Z .; Wang, Z .; Wang, F .; Chen, X .; Liu, X .; Feng, X .; Su, Z .; Hu, C. (2008). „Asymetrická přímá aldolová reakce funkcionalizovaných ketonů katalyzovaných aminovými organokatalyzátory na bázi bispidinu“. J. Am. Chem. Soc. 130 (17): 5654–5655. doi:10.1021 / ja800839w. PMID 18380434.
- ^ Bautz, J .; Comba, P .; Lopez de Laorden, C .; Menzel, M .; Rajaraman, G. (2007). „Biomimetické High-Valent nehemové oxidy železa pro cis-dihydroxylaci a epoxidaci olefinů †“. Angew. Chem. Int. Vyd. 46 (42): 8067–8070. doi:10.1002 / anie.200701681. PMID 17868164.
- ^ Ruenitz, P.C .; Mokler, C.M. (1997). „Analogy sparteinu. 5. Antiarytmická aktivita vybraných„ disubstituovaných bispidinů “. J. Med. Chem. 20 (12): 1668–1671. doi:10.1021 / jm00222a026. PMID 592332.
- ^ Samhammer, A .; Holzgrabe, U .; Haller, R. (1989). „Synthese, Stereochemie und analgetische Wirkung von 3,7 ‐ Diazabicyclo [3.3.1] nonan ‐ 9 ‐ onen a 1,3 ‐ Diazaadamantan ‐ 6 ‐ onen)“. Archiv der Pharmazie. 322 (9): 551–555. doi:10,1002 / ardp.19893220908. PMID 2610588.
- ^ Siener, T .; Holzgrabe, U .; Drosihn, S .; Brandt, W. (1999). „Konformační a konfigurační chování κ-agonistických 3,7-diazabicyklo [3.3.1] nonan-9-onů - syntéza, studie nukleární magnetické rezonance a semiempirické výpočty PM3“. Journal of the Chemical Society, Perkin Transactions 2. 2 (9): 1827–1834. doi:10.1039 / A806641H.
- ^ Comba, P .; Kubeil, M .; Pietzsch, J .; Rudolf, H .; Stephan, H .; Zarschler, K. (2014). „Bispidin Dioxotetraaza Macrocycles: a New Class of Bispidines for 64Cu PET Imaging“. Anorganická chemie. 53 (13): 6698–6707. doi:10.1021 / ic500476u. PMID 24906110.
- ^ Rossetti, A .; Lippi, M .; Marti-Rujas, J .; Sacchetti, A .; Canetti, M. (2018). "Vysoce dynamické a laditelné chování 1D koordinačních polymerů založených na ligandu bispidinu". Chem. Eur. J. 24 (72): 19368–19372. doi:10.1002 / chem.201804782. PMID 30325090.
