Zeď spojená kináza - Wall-associated kinase
| Zeď spojená kináza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
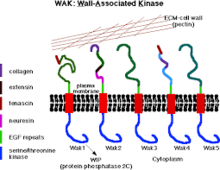 WAK a pektin v buněčné stěně | |||||||||
| Identifikátory | |||||||||
| Symbol | WAK | ||||||||
| Pfam | PF08488 | ||||||||
| InterPro | IPR013695 | ||||||||
| Membranome | 725 | ||||||||
| |||||||||
Zeď spojené kinázy (WAK) jsou jednou z mnoha tříd rostlinných proteinů, o nichž je známo, že slouží jako médium mezi extracelulární matrix (ECM) a cytoplazma buněčné stěny. Jsou to serin-threonin kinázy, které obsahují epidermální růstový faktor (EGF) repetice, cytoplazmatická kináza, a jsou umístěny v buněčných stěnách.[1] Poskytují spojení mezi vnitřním a vnějším okolím buněčných stěn.[2] WAK jsou pod skupinou receptorů kinázy (RLK), které se aktivně účastní smyslových a dráhy přenosu signálu zejména v reakci na cizí útoky patogenů[3] a ve vývoji buněk.[4] Na druhou stranu, pektiny jsou hojnou skupinou komplexních sacharidů přítomných v primární buněčné stěně, které hrají roli v buněčném růstu a vývoji, ochraně, struktuře rostlin a schopnosti zadržovat vodu.
Kinázy spojené s buněčnou stěnou jsou podobné receptorům proteinové kinázy, nalezený v rostlině buněčné stěny, které mají schopnost přenášet signály přímo svými cytoplazmatickými kinázovými doménami.[5] Obvykle spojují plazmatickou membránu s bílkovinami a sacharidy, které tvoří buněčnou stěnu.[5] Receptorové proteiny obsahují cytoplazmatickou serin threonin kinázu a méně konzervovanou oblast; vázán na buněčnou stěnu a obsahuje řadu epidermálních růstový faktor opakuje.[6] WAK se nacházejí v různých rostlinách a plodinách, jako je rýže,[7] a kukuřice.[8] V rostlinách podobný genomu Arabidopsis, WAK, jsou kódovány pěti vysoce podobnými geny seskupenými do lokusu 30 kb,[6] mezi nimi jsou WAK1 a WAK2 vysoce distribuované.[5] Primárně se podílejí na regulaci funkcí buněčné stěny rostlin[5] včetně expanze buněk,[9] vázat stejně jako odpověď na pektiny,[10] reakce patogenů a také chrání rostliny před škodlivými účinky.[5]
Pektiny jsou bohaté na kyseliny galakturonové (OG) a přítomný uprostřed lamely v rostlinných tkáních, kde poskytují sílu, pružnost a adhezi mezi rostlinnými buňkami.[11] Komerčně a v potravinářském průmyslu se používají jako gely a stabilizátory pro dezerty a džusy. Role WAK v buněčných stěnách jako pektinových receptorech je zásadní pro různé funkce spojené s buněčnou diferenciací, formou a vztahy mezi hostitelem a patogenem.[12]
Dějiny
Asociace WAK se stěnou rostlinných buněk byla nejprve narušena imunolokalizace pomocí techniky antisérum kde ztělesnění Bylo zjištěno, že WAK jsou pevně spojeny s fragmenty buněčné stěny, takže je nelze oddělit pomocí detergentu, nicméně WAK by se mohly uvolnit vařením stěn pomocí BL, dithiothreitol (silné thiolové redukční činidlo), protoplastující enzymy nebo pektináza.[13][9]
Gen
Protein WAK složený z pěti typů vysoce podobných genů umístěných těsně ve shlucích 30 kb Arabidopsis genom.[13][14] Většina WAK je exprimována v celé rostlině bez ohledu na to, zda jsou WAK1, 2, 3 a 5 exprimovány v zelených orgánech, WAK1 a 2 slabě exprimovány v květinách a silikátech a WAK2 je exprimován také v kořenech, avšak WAK4 je exprimován pouze v silikátech.[15] Existuje také 21 genů podobných WAK Arabitopsis genom známý jako WAKL, které mají malou sekvenční podobnost s WAK.[16]
Geny Ara WAK a WAKL jsou distribuovány mezi všech pět chromozomů Arabidopsis
| Číslo chromozomu | Lokalizované geny |
|---|---|
| Já | WAKL1-13, WAKL22, WAK1-5 |
| II | WAKL14 |
| III | WAKL14 |
| III | WAKL15, WAKL16 |
| IV | WAKL17, WAKL18, WAKL19 |
| PROTI | WAKL20, WAKL21 |
Členové rodiny genů WAK / WAKL v Arabidopsis byly rozděleny do čtyř skupin na základě párového srovnání jejich predikovaných proteinových sekvencí. WAK1 až WAK5 obsahující EGF-Ca2+ doména s překrývajícím se hydroxylačním místem Asp / Asn a doména EGF-2 byly umístěny do skupiny I. Předpovídalo se, že obě domény EGF budou úplně kódovány druhým exonem. Sedm členů WAKL, kteří zahrnují WAKL1 až WAKL6 a WAKL22, bylo umístěno do skupiny II. Ve všech těchto genech skupiny II byl EGF-Ca2+ a EGF-2 domény jsou odděleny krátkou mezerou 15-18 aa byly obráceny v pořadí vzhledem ke skupině I. EGF-Ca2+ doména je kódována prvním exonem a EGF-Ca2+ doména je kódována druhým exonem. Nebylo předpovídáno žádné místo hydroxylace Asn / asp.[17]
Skupina III obsahuje šest členů: WAKL9, WAKL10, WAKL11, WAKL13, WAKL17 a WAKL18. Všechny jejich odpovídající proteiny obsahují EGF-Ca2+ a EGF2 domény a jsou strukturně podobné WAKL skupiny II. Ve WAKL13 je EGF-Ca2+ doména je zdegenerovaná. S výjimkou WAKL17 mají všechny degenerované domény EGF2.[17]
Skupina IV obsahuje čtyři členy: WAKL14, WAKL15, WAKL20 a WAKL21. Každá z nich má doménu EGF2 kódovanou prvním exonem. Tato doména je zdegenerována jak u WAKL20, tak u WAKL21. Všem čtyřem členům chybí EGF-Ca2+ doména. Kromě toho má každý cytoplazmatickou proteinovou kinázu vázající doménu ATP (PS00107). Předpokládá se, že zbývající sekvence (WAKL7, WAKL8, WAKL12, WAKL16 a WAKL19) kódují zkrácené WAKL proteiny. WAKL7, WAKL8 a WAKL19 jsou podobné různým jiným WAKL ve svých extracelulárních oblastech a postrádají transmembránovou doménu. WAKL8 a WAKL9 oba obsahují EGF-Ca2+ doména a WAKL19 obsahuje degenerovanou doménu EGF2. Žádná z těchto domén není ve WAKL7 přítomna. WAKL12 také obsahuje EGF-Ca2+ doména, ale na rozdíl od WAKL8 obsahuje transmembránovou doménu. WAKL16 obsahuje transmembránovou doménu, STK doménu, která je nejvíce podobná WAK3, a krátkou extracelulární doménu osmi aminokyselin, které postrádají obě domény podobné EGF.[17]
Rodiny
Wall-Associated Kinases (WAKs) jsou podrodinou receptorových kináz (RLK) asociovaných s buněčnou stěnou.[13] Byly popsány v Arabidopsis thaliana jako shluk pěti (WAK1-5),[14] a 22 (WAKL1-WAKL22) genů.[16]
Rodina genů WAK / WAKL (OsWAK) v rýži[18]
- OsWAK-RLK (receptory podobné kinázy) - obsahují jak extracelulární domény podobné EGF, tak intracelulární kinázovou doménu[18]
- OsWAK-RLCK (cytoplazmatické kinázy podobné receptorům) - obsahují pouze doménu kinázy[18]
- OsWAK-RLP (proteiny podobné receptoru) - obsahují pouze extracelulární domény podobné EGF[18]
- Krátké geny OsWAK - postrádající obě domény, ale má> 40% identitu na úrovni aminokyselin s ostatními členy OsWAK[18]
- pseudogeny (buď se stop kodony nebo s rámcovými posuny v kódující oblasti)[18]
Struktura
Všech pět proteinů WAK má vysoce konzervovanou doménu serin / threoninové proteinové kinázy (86% podobnost) na cytoplazmatické straně a extracelulární doménu (pouze 40% až 64% podobnost v aminokyselinových sekvencích).[14][19][6] Navíc všechny izomery proteinů WAK mají opakování podobné epidermálnímu růstovému faktoru (EGF) umístěné na aminoterminální straně.[6] Šest cysteinů (umístěných v repetici EGF) je udržováno ve všech pěti WAK, nicméně interakce proteinů s proteiny WAks jsou stále neznámé.[20]
Všechny WAK (WAK 1-5) mají Asp / Asn hydroxylační místo (Cx [DN] x (4) [FY] xCxC; Prosite PS00010) překrývající se s doménami EGF vázajícími vápník, kde mají jak hydroxylované, tak nehydroxylované formy koagulačních proteáz stejnou afinitu k vápník ve fyziologických koncentracích.[15] Hydroxylová skupina může být zapojena do vodíkové vazby v interakcích protein-protein zprostředkovaných doménou podobnou EGF.[21]
Spojení WAK s buněčnou stěnou je velmi silné (má kovalentní vazbu na pektin), takže jeho uvolňování z buněčné stěny vyžaduje enzymatické trávení.[22] Za podmínek, které kolabují turgor rostlinné buňky tak, aby se oddělila membrána od stěny (plazmolýza), je asociace WAKs-stěna tak silná, že zůstává v buněčné stěně. Existuje pět izoforem WAK Arabidopsis s variabilní extracelulární doménou v rámci této izoformy, které všechny obsahují alespoň dva epidermální růstové faktory (EGF). Ze všech těchto izoforem jsou WAK1 a WAK2 nejvíce všudypřítomné a jejich messengerová RNA (mRNA) a proteiny jsou přítomny ve vegetativním meristému a oblastech buněčné expanze.[22]
Interakce
WAK1 je zesítěný v endomembrány a jeho transport na povrch buňky vyžaduje správnou syntézu buněčné stěny.[23] Interakce mezi WAK1 a pektiny (Pektiny jsou komplexní oligopolysacharidy tvořené hydrofilní gelovitou matricí mezi celulózovými mikrofibrilami a mohou být koncentrovány v různých oblastech buněčné stěny)[24] bylo potvrzeno použitím anti-WAK1 a anti-pektinových protilátek JIM5 a JIM7 rozpoznaly stejný proteinový pás 68 kDa v západní bloty proteinů buněčné stěny extrahovaných z buněčných stěn ošetřených pektinázou.[9] Tento hybrid pektin-kinázy lokalizovaný pro hlášení do cytoplazmy na buněčné stěně, kde je WAK1 vázán v konformaci vyvolané vápníkem na kyselinu polygalakturonovou, oligogalakturonidy a pektiny, a této interakci bylo zabráněno methylesterifikací, chelatátory vápníku a depolymerací pektinu.[25][26] Interakce pektinového polyanionu s buněčnou stěnou nebo plazmalemem by mohla vyvolat konformační změny v pektinových polymerech, které ovlivňují jejich gelovatění a bobtnání v přítomnosti vápníku[27] a může dojít k navázání pektinů na WAK1 v přítomnosti vápníku Muro poruchy pektinové sítě, které by mohly generovat signály uvnitř buněčné stěny.[27]
Funkce
Kinázy spojené se stěnou (WAK) přispívají několika funkcemi (buněčné dělení nebo růst) jako jiné receptory rostlin, jako jsou senzory buněčné stěny, avšak jedinečnou vlastností je vázat se přímo na pektin který postuluje signální dráhu závislou na WAK regulující expanzi buněk.[6] Přispívají také k patogenním a stresovým reakcím,[6] tolerance těžkých kovů,[17] a vývoj rostlin.[6]
WAK mohou přispívat k prodloužení buněk, protože mají aktivní cytoplazmatické protein kináza doména, která překlenuje plazmatickou membránu, a obsahuje N konec, který váže buněčnou stěnu, ať WAK2 může regulovat invertázu na transkripční úroveň.[28] WAK mohou také regulovat expanzi buněk kontrolou koncentrace cukru a tím turgor ovládání kde wak2-1 fenotyp lze zachránit expresí fosfosyntázy sacharózy, která mění poklesy cukru.[29] Antisense WAK RNA může být indukována pomocí Dex systém, který přispívá k 50% snížení hladiny proteinu WAK a také k menší velikosti buněk, spíše než k menšímu počtu buněk.[30][31][32] A wak2-1 (WAK2 nulová alela) způsobuje ztrátu buněčné expanze v kořenech, ale pouze za omezených podmínek cukru a soli,[29] individuální ztráta funkčních alel v žádné ze čtyř dalších WAK však nevede ke zjevnému fenotypu.[14] Kohorn et al. (2006a) navrhli, že WAK mohou být zesítěny s materiálem buněčné stěny, avšak sestavování a zesíťování WAK začíná v rané fázi spíše v cytoplazmatickém kompartmentu než v samotné buněčné stěně a také je koordinováno se syntézou povrchové celulózy.[23] WAK se uvolňují z pektinázy materiálu buněčné stěny, kde jsou vázány na pektiny.[30][32] Proto se WAK1 nebo 2 váže na pektin mají vyšší afinitu k deesterifikovanému pektinu než k esterifikovaným molekulám. Kromě toho krátké fragmenty pektinu stupně polymerace (dp) 9–15 účinně soutěžily o delší pektiny o vazbu WAK.[29][33] Jak WAK1, tak WAK 2 se vážou na různé pektiny včetně polymerů homogalakturonanu (HA), OG a na rhamnogalakturonany (RG) I a II.[33] Požadavky na vazbu se nevztahují na jednoduchý polymer HA, ale možná na přítomnost kyseliny galakturonové.[33] Biologická aktivita fragmentů pektinu neboli OG přispívá k obranným a stresovým reakcím a ve vývojových procesech, kde WAK fungují jako receptor.[34][35][36][37]
Se stěnami spojené kinázy se účastní patogenních a stresových reakcí.[29]
Dráha přenosu signálu
Kohorn (2016) navrhl, že „pektinové polymery mohou být zesítěny v buněčné stěně s Ca+a WAK se vážou na tyto pektiny a signál aktivací vakuolární invertázy a mnoha dalších indukovaných proteinů napomáhají buněčné expanzi. Stav methylesterifikace pektinu je modulován pektinmethylesterázami (PME) a WAK váží de-methylovaný pektin s vyšší afinitou. Pektin je fragmentován biotickými a abiotickými událostmi a oligo-galakturonidy (OG), mají vyšší afinitu k WAK a vyvolávají stresovou reakci. “[38]
WAK váží pektin
Kinázy spojené se stěnou jsou receptory s vápníkem zprostředkovaným zesítěním na buněčnou stěnu rostlin.[39][40] Přítomnost a kyselina galakturonová páteř v různých typech pektinu se předpokládá jako zásadní vlastnost pro vazbu na WAK, protože WAK1 a WAK2 se vážou na různé pektiny včetně polymerů homogalakturonanu (HA), nejhojnějšího pektinu v buněčných stěnách;[41] Oligogalakturonové kyseliny (OG) a rhamnogalakturonany (RG) I a II.[42] Vazba in vitro mezi WAK a pektinem je usnadněna nabitými kyslíkovými skupinami na čistých pektinových fragmentech a nabitými zbytky na ECM WAK.[43]
Pektináza Enzym odpovědný za degradaci pektinu přítomného v buněčné stěně uvolňuje WAK, což se stalo primárním návrhem, aby se WAK vázaly na pektin v buněčné stěně.[42] Kromě toho tato hypotéza navrhla kovalentní vazbu mezi pektinem a WAK, protože jsou po expozici detergentu na sebe stále navázány Dodecylsulfát sodný (prací prostředek) a Dithiothreitol (DTT) a v akrylamidové gely.[2] Pektinmethylesterázy (PME) odstraňují methylové skupiny vznikající z enzymu, který polymeruje pektiny (polymer methylesterifikované kyseliny α- (1–4) D-galakturonové), což vede k deesterifikovanému polymeru pektinu.[44] WAK se snadněji vážou na deesterifikované pektiny kvůli jejich negativnějšímu náboji. Tento návrh, že náboj je zodpovědný za výhodnou vazbu WAK na deesterifikované pektiny (záporně nabité), se ukázal při mutaci kationtových zbytků v genu WAK1 na neutrální zbytky, což mělo za následek ztrátu vazebných vlastností k deesterifikovaným pektinům .[2]
Tato role náboje ve vazbě je dále prokázána substitucí arginin zbytky pro glutamin a lysin pro threoniny v ECM, která vykazuje sníženou vazbu na deesterifikovaný pektin.[43] Deesterifikace pektinů je proto nutností pro aktivaci WAK.
Molekulární interakce WAK a pektinu
Modelka
Vazba WAK na pektiny spouští fungování několika cest. Fragmentace pektinů (kyselina oligogalakturonová) během poranění nebo patogenního napadení vede k rostlinné stresové reakci a WAK hrají roli při zprostředkování této reakce. Jelikož jsou však WAK také potřebné pro růst buněk vazbou na dlouhé pektinové polymery pro vývoj rostlin a také na pektinové fragmenty pro reakci na zranění, nebyly nalezeny žádné způsoby, jak WAK rozlišuje mezi těmito dvěma typy pektinů, aby buď zahájily prodloužení nebo ochranu buněk .[39] Byl však navržen model, který demonstruje preference WAK pro deesterifikované pektiny a možné vysvětlení pro zahájení reakce patogenu spíše než reakce růstu.
Ukázalo se, že dominantní alela WAKs, která vyžaduje doménu vázající pektin a aktivitu kinázy, indukuje stresovou reakci, avšak tato alela byla potlačena nulovou alelou pektinmethylesterázy (pme), což zabraňovalo odstranění methylových skupin, které polymerují pektin na deesterifikovaný polymer, což vede k esterifikovanému pektinu. Vzhledem k tomu, že WAK se v esterifikovaných pektinech váže volněji, bylo přítomno více pro vazbu oligogalakturonových kyselin (u tohoto mutanta), čímž se spíše vyvolala stresová reakce patogenu než růstová reakce.[39] WAK závislá aktivace dráhy buněčné expanze zahrnuje aktivaci MPK3, zatímco reakce patogenu ukazuje aktivaci jak MPK3, tak MPK6.[42]
WAK1 a WAK2 jsou nejvíce exprimovanými proteinovými variantami WAKS z pěti WAK známých u Arabidopsis, avšak WAK1 je nejvíce exprimován ve vaskulatuře, zatímco WAK2 je také exprimován v orgánových spojeních, abscisčních zónách a meristemech.[40]
WAK1: patogenní reakce
Cesta patogenu k infekci začíná buněčnou stěnou; proteiny, které spojují buněčnou stěnu s plazmatickou membránou, jsou počátečními mediátory reakce patogenu. WAK1 je indukován v patogenní reakci rostliny spolu s dalšími proteiny souvisejícími s patogeny, které fungují při ochraně. Wak1 je přítomen v rostlinné tkáni Arabidopsis, s expresí mRNA WAK1 hojněji v rostlinném kmeni, listech než v kořenech a jeho extracelulární doména obsahuje epidermální růst se opakuje který usnadňuje buněčnou signalizaci. Teplo a sůl nemají vliv na produkci WAK1 v tkáních, avšak poranění je významné, protože způsobuje expresi zprávy WAK1 kyselinou 2,2-dichlorisonikotinovou (INA), což je přírodní salicylát (SA) v signální transdukční cestě v reakce rostliny na infekci. Protože WAK1 je životně důležitý pro přežití rostliny v reakci na patogeny, současně poskytuje rezistenci vůči SA do bodu, kdy rostlina může přežít vystavení vysokým hladinám SA.[45] Zvýšená odolnost vůči SA prostřednictvím exprese WAK1 může být udělena pouze ektopickou expresí celé domény proteinu nebo kinázy WAK1.[45] To v konečném důsledku znamená, že vyvolání exprese WAK1 způsobuje snížené hladiny SA a sníženou toxicitu, tedy ochranu, což dokazuje roli WAK1 v regulaci patogenních útoků.
WAK2: exprese pektinu a genu
Pektin ovlivňuje expresi genů závislých na WAK2, jako jsou ty, které se účastní integrity buněčné stěny a vnější reakce;[43][39] Předpokládá se, že WAK2 je důležitý v buněčných událostech a genové expresi v Arabidopsis mesophyll. Genová exprese pomocí expresních polí Affymetrix s RNA z divokého typu nebo wak2-1 (nulová mutace) protoplasty ošetřené nebo neošetřené pektinem odhalují řadu věcí. U protoplastů divokého typu ošetřených pektinem došlo ke změně exprese více než 200 genů, přičemž téměř 50 z upregulovaných genů jsou ty, které se podílejí na syntéze buněčné stěny, jako je pektinesteráza, na leucin bohatá transmembránová kináza, rostlinný defensin. Zbytek downregulovaných genů zahrnoval ty, které se účastní více funkcí v rostlině; rozdílně byl však exprimován pouze jeden gen ve WAK2-1 ošetřeném pektinem. Ve srovnání s wak2-1 bylo 13 z 50 upregulovaných genů divokého typu potlačeno u wak2-1 a 37 bylo exprimováno podobně jako divokého typu. 20 genů v těch downregulovaných vykazovalo sníženou expresi v wak2-1 buněk, 24 bylo aktivováno a zbytek měl hladiny podobné divokému typu.[43]
Tyto vzorce umožňovaly identifikaci genů regulovaných WAK2 bez léčby pektiny, ty nezávislé na WAK2, ale závislé na pektinové odpovědi WAK2. Exprese WAK2 ve wak2-1 (nulová mutace) vykázala největší snížení exprese, což naznačuje, že gen nebyl transkribován. WAK1 a WAK2 byly upregulovány u divokých typů ošetřených pektinem, ale u wak2-1 to nebylo pozorováno.[43] Je zřejmé, že WAK2 je důležitou součástí signální dráhy pektinu, protože absence WAK2 může značně snížit transkripční odpověď na pektin. Jak upregulované, tak downregulované WAK2-dependentní pektinové geny reagují buď na obranu, strukturu buněčné stěny, na proteinovou fosforylaci nebo na transkripční faktory.[43]
Reference
- ^ Kohorn BD (říjen 2001). "WAK; kinázy spojené s buněčnou stěnou". Aktuální názor na buněčnou biologii. 13 (5): 529–33. doi:10.1016 / S0955-0674 (00) 00247-7. PMID 11544019.
- ^ A b C Wagner TA, Kohorn BD (únor 2001). "Kinázy spojené se stěnou jsou exprimovány během vývoje rostlin a jsou nutné pro buněčnou expanzi". Rostlinná buňka. 13 (2): 303–18. doi:10,1105 / tpc.13.2.303. PMC 102244. PMID 11226187.
- ^ Yang K, Qi L, Zhang Z (2014). „Izolace a charakterizace nového genu kinázy TaWAK5 spojeného se stěnou u pšenice (Triticum aestivum)“. The Crop Journal. 2 (5): 255–266. doi:10.1016 / j.cj.2014.04.010.
- ^ Receptorové kinázy v rostlinách. Signalizace a komunikace v závodech. 13. SpringerLink. 2012. doi:10.1007/978-3-642-23044-8. ISBN 978-3-642-23043-1. S2CID 6532313.
- ^ A b C d E Anderson, Catherine M .; Wagner, Tanya A .; Perret, Mireille; On, Zheng-Hui; On, Deze; Kohorn, Bruce D. (2001). "WAKs: Buněčné stěny spojené s kinázami spojujícími cytoplazmu s extracelulární matricí". Molekulární biologie rostlin. 47 (1–2): 197–206. doi:10.1023 / A: 1010691701578. PMID 11554472.
- ^ A b C d E F G Kohorn, Bruce D; Kohorn, Susan L (2012). „Kinázy spojené s buněčnou stěnou, WAK, jako pektinové receptory“. Hranice ve vědě o rostlinách. 3: 88. doi:10.3389 / fpls.2012.00088. PMC 3355716. PMID 22639672.
- ^ De Oliveira, Luiz Felipe Valter; Christoff, Ana Paula; De Lima, Júlio Cesar; De Ross, Bruno Comparsi Feijó; Sachetto-Martins, Gilberto; Margis-Pinheiro, Marcia; Margis, Rogerio (2014). "Rodina genů kinázy spojené se stěnou v genomech rýže". Plant Science. 229: 181–92. doi:10.1016 / j.plantsci.2014.09.007. PMID 25443845.
- ^ Zuo, Weiliang; Chao, Qing; Zhang, Nan; Ye, Jianrong; Tan, Guoqing; Li, Bailin; Xing, Yuexian; Zhang, Boqi; Liu, Haijun; Fengler, Kevin A; Zhao, Jing; Zhao, Xianrong; Chen, Yongsheng; Lai, Jinsheng; Yan, Jianbing; Xu, Mingliang (2014). „Kináza spojená se stěnou kukuřice uděluje kvantitativní odolnost proti hnilobě hlavy“. Genetika přírody. 47 (2): 151–7. doi:10,1038 / ng.3170. PMID 25531751.
- ^ A b C Wagner, Tanya A .; Kohorn, Bruce D. (2001). "Kinázy spojené se stěnou jsou exprimovány během vývoje rostlin a jsou nutné pro buněčnou expanzi". Rostlinná buňka. 13 (2): 303–18. doi:10.1105 / tpc.13.2.303. JSTOR 3871278. PMC 102244. PMID 11226187.
- ^ Kohorn, Bruce D; Kobayashi, Masaru; Johansen, Sue; Riese, Jeff; Huang, Li-Fen; Koch, Karen; Fu, Sarita; Dotson, Anjali; Byers, Nicole (2006). "Kináza spojená s buněčnou stěnou Arabidopsis potřebná pro aktivitu invertázy a růst buněk". The Plant Journal. 46 (2): 307–16. doi:10.1111 / j.1365-313X.2006.02695.x. PMID 16623892.
- ^ Willats WG, McCartney L, Mackie W, Knox JP (2001). Stěny rostlinných buněk. Springer, Dordrecht. str. 9–27. doi:10.1007/978-94-010-0668-2_2. ISBN 9789401038614.
- ^ Decreux A, Messiaen J (únor 2005). „Kináza WAK1 spojená se stěnou interaguje s pektiny buněčné stěny v konformaci vyvolané vápníkem“. Fyziologie rostlin a buněk. 46 (2): 268–78. doi:10.1093 / pcp / pci026. PMID 15769808.
- ^ A b C On, Zheng-Hui; Fujiki, Masaaki; Kohorn, Bruce D (1996). „Protein kináza spojená s buněčnou stěnou, podobná receptoru“. Journal of Biological Chemistry. 271 (33): 19789–93. doi:10.1074 / jbc.271.33.19789. PMID 8702686.
- ^ A b C d On, Zheng-Hui; Cheeseman, Iain; On, Deze; Kohorn, Bruce D (1999). „Shluk pěti genů receptorových kináz asociovaných s buněčnými stěnami, Wak1-5, jsou exprimovány ve specifických orgánech Arabidopsis“. Molekulární biologie rostlin. 39 (6): 1189–96. doi:10.1023 / A: 1006197318246. PMID 10380805.
- ^ A b Decreux, Annabelle; Messiaen, Johan (2005). „Kináza WAK1 spojená se stěnou interaguje s pektiny buněčné stěny v konformaci vyvolané vápníkem“. Fyziologie rostlin a buněk. 46 (2): 268–78. doi:10.1093 / pcp / pci026. PMID 15769808.
- ^ A b Verica, J. A; On, Z. H (2002). „Kináza asociovaná s buněčnou stěnou (WAK) a kinázová genová kináza podobná WAK“. Fyziologie rostlin. 129 (2): 455–9. doi:10.1104 / pp.011028. JSTOR 4280478. PMC 1540232. PMID 12068092.
- ^ A b C d E Kanneganti, Vydehi; Gupta, Aditya K (2008). "Zeď spojené kinázy z rostlin - přehled". Fyziologie a molekulární biologie rostlin. 14 (1–2): 109–18. doi:10.1007 / s12298-008-0010-6. PMC 3550657. PMID 23572878.
- ^ A b C d E F Zhang, S; Chen, C; Li, L; Meng, L; Singh, J; Jiang, N; Deng, X. W; On, Z. H; Lemaux, P. G (2005). „Evoluční expanze, struktura genů a exprese rodiny kinázových genů spojených s rýžovou stěnou“. Fyziologie rostlin. 139 (3): 1107–24. doi:10.1104 / str. 105,069005. JSTOR 4281942. PMC 1283751. PMID 16286450.
- ^ Sampoli Benitez, Benedetta A; Komives, Elizabeth A (2000). "Plastickost disulfidových vazeb v epidermálním růstovém faktoru". Proteiny: struktura, funkce a genetika. 40 (1): 168–74. doi:10.1002 / (SICI) 1097-0134 (20000701) 40: 1 <168 :: AID-PROT180> 3.0.CO; 2-N. PMID 10813841.
- ^ Sivaguru, M; Ezaki, B; On, Z. H; Tong, H; Osawa, H; Baluska, F; Volkmann, D; Matsumoto, H (2003). „Exprese genu indukovaná hliníkem a lokalizace proteinu kinázy asociované s buněčnou stěnou u Arabidopsis“. Fyziologie rostlin. 132 (4): 2256–66. doi:10.1104 / pp.103.022129. PMC 181309. PMID 12913180.
- ^ Stenflo, Johan; Stenberg, Yvonne; Muranyi, Andreas (2000). „Vápník vázající moduly EGF v koagulačních proteinázách: Funkce iontu vápníku v interakcích modulů“. Biochimica et Biophysica Acta (BBA) - proteinová struktura a molekulární enzymologie. 1477 (1–2): 51–63. doi:10.1016 / S0167-4838 (99) 00262-9. PMID 10708848.
- ^ A b Kohorn, Bruce D; Kohorn, Susan L (2012). „Kinázy spojené s buněčnou stěnou, WAK, jako pektinové receptory“. Hranice ve vědě o rostlinách. 3: 88. doi:10.3389 / fpls.2012.00088. PMC 3355716. PMID 22639672.
- ^ A b Kohorn, Bruce D .; Kobayashi, Masaru; Johansen, Sue; Friedman, Henry Perry; Fischer, Andy; Byers, Nicole (2006). „Wall-associated kinase 1 (WAK1) is crosslinked in endomembranes, and transport to the cell surface requires correct cell-wall recognition“. Journal of Cell Science. 119 (11): 2282–90. doi:10.1242 / jcs.02968. PMID 16723734.
- ^ Carpita, Nicholas C; Gibeaut, David M (1993). "Strukturální modely primárních buněčných stěn v kvetoucích rostlinách: Konzistence molekulární struktury s fyzikálními vlastnostmi stěn během růstu". The Plant Journal. 3 (1): 1–30. doi:10.1111 / j.1365-313X.1993.tb00007.x. PMID 8401598.
- ^ Decreux, A; Thomas, A; Spies, B; Brasseur, R; Cutsem, P; Messiaen, J (2006). „In vitro charakterizace homogalakturonan-vazebné domény kinázy WAK1 spojené se stěnou pomocí místně cílené mutageneze“. Fytochemie. 67 (11): 1068–79. doi:10.1016 / j.phytochem.2006.03.009. PMID 16631829.
- ^ Deeks, Michael J; Hussey, Patrick J; Davies, Brendan (2002). „Formins: Intermediates in signal-transduction cascades that impact cytoskeletal reorganisation“. Trendy ve vědě o rostlinách. 7 (11): 492–8. doi:10.1016 / S1360-1385 (02) 02341-5. PMID 12417149.
- ^ A b MacDougall, Alistair J; Brett, Gary M; Morris, Victor J; Rigby, Neil M; Ridout, Michael J; Ring, Stephen G (2001). "Vliv interakcí peptid-pektin na chování gelovatění pektinu rostlinné buněčné stěny". Výzkum sacharidů. 335 (2): 115–26. doi:10.1016 / S0008-6215 (01) 00221-X. PMID 11567642.
- ^ Wagner, T. A.; Kohorn, B.D. (2001). "Kinázy spojené se stěnou jsou exprimovány během vývoje rostlin a jsou nutné pro buněčnou expanzi". Rostlinná buňka. 13 (2): 303–318. doi:10.1105 / tpc.13.2.303. PMC 102244. PMID 11226187.
- ^ A b C d Kohorn B. D., Kobayashi M., Johansen S., Riese J., Huang L. F., Koch K., Fu S., Dotson A., Byers N. (2006b). Kináza spojená s buněčnou stěnou Arabidopsis potřebná pro aktivitu invertázy a růst buněk. Závod J. 46 307–316
- ^ A b Anderson C. M., Wagner T. A., Perret M., He Z. H., He D., Kohorn B. D. (2001). WAK: kinázy spojené s buněčnou stěnou spojující cytoplazmu s extracelulární matricí. Plant Mol. Biol. 47 197–206
- ^ Lally, D .; Ingmire, P .; Tong, H. Y .; On, Z. H. (2001). "Antisense exprese proteinové kinázy asociované s buněčnou stěnou, WAK4, inhibuje prodloužení buněk a mění morfologii". Rostlinná buňka. 13 (6): 1317–1331. doi:10.2307/3871298. JSTOR 3871298. PMC 135583. PMID 11402163.
- ^ A b Kohorn, B. D. (2001). "WAK; kinázy spojené s buněčnou stěnou". Curr. Opin. Cell Biol. 13 (5): 529–533. doi:10.1016 / s0955-0674 (00) 00247-7. PMID 11544019.
- ^ A b C Kohorn BD, Johansen S, Shishido A, Todorova T, Martinez R, Defeo E, Obregon P (prosinec 2009). „Pektinová aktivace MAP kinázy a genová exprese je závislá na WAK2“. Rostlina J. 60 (6): 974–82. doi:10.1111 / j.1365-313X.2009.04016.x. PMC 3575133. PMID 19737363.
- ^ Yamazaki, N .; Fry, S. C .; Darvill, A. G .; Albersheim, P. (1983). "Interakce hostitel-patogen: XXIV. Fragmenty izolované z buněčných stěn kultivace platanu kultivovaného v suspenzi inhibují schopnost buněk zabudovat [C] leucin do proteinů". Plant Physiol. 72 (3): 864–869. doi:10,1104 / str. 72,3,864. PMC 1066335. PMID 16663100.
- ^ Willats WG, McCartney L, Mackie W, Knox JP (září 2001). "Pektin: buněčná biologie a vyhlídky na funkční analýzu". Plant Mol. Biol. 47 (1–2): 9–27. doi:10.1023 / A: 1010662911148. PMID 11554482.
- ^ Mohnen D (červen 2008). "Pektinová struktura a biosyntéza". Curr. Opin. Plant Biol. 11 (3): 266–77. doi:10.1016 / j.pbi.2008.03.006. PMID 18486536.
- ^ Harholt J, Suttangkakul A, Vibe Scheller H (červen 2010). „Biosyntéza pektinu“. Plant Physiol. 153 (2): 384–95. doi:10.1104 / pp.110.156588. PMC 2879803. PMID 20427466.
- ^ Kohorn, Bruce D (2016). "Kinázy spojené s buněčnou stěnou a vnímání pektinu". Journal of Experimental Botany. 67 (2): 489–94. doi:10.1093 / jxb / erv467. PMID 26507892.
- ^ A b C d Kohorn BD (08.08.2015). „Stav pektinu buněčné stěny sledovaný kinázami spojenými se stěnou: model“. Signalizace a chování zařízení. 10 (7): e1035854. doi:10.1080/15592324.2015.1035854. PMC 4622591. PMID 26251881.
- ^ A b Kohorn BD (leden 2016). "Kinázy spojené s buněčnou stěnou a vnímání pektinu". Journal of Experimental Botany. 67 (2): 489–94. doi:10.1093 / jxb / erv467. PMID 26507892.
- ^ Voragen, Alphons G. J .; Coenen, Gerd-Jan; Verhoef, René P .; Schols, Henk A. (2009-04-01). „Pektin, všestranný polysacharid přítomný v buněčných stěnách rostlin“. Strukturální chemie. 20 (2): 263. doi:10.1007 / s11224-009-9442-z.
- ^ A b C Kohorn BD, Kohorn SL (2012). „Kinázy spojené s buněčnou stěnou, WAK, jako pektinové receptory“. Hranice ve vědě o rostlinách. 3: 88. doi:10.3389 / fpls.2012.00088. PMC 3355716. PMID 22639672.
- ^ A b C d E F Kohorn BD, Johansen S, Shishido A, Todorova T, Martinez R, Defeo E, Obregon P (prosinec 2009). „Pektinová aktivace MAP kinázy a genová exprese je závislá na WAK2“. The Plant Journal. 60 (6): 974–82. doi:10.1111 / j.1365-313x.2009.04016.x. PMC 3575133. PMID 19737363.
- ^ Kohorn BD (leden 2016). "Kinázy spojené s buněčnou stěnou a vnímání pektinu". Journal of Experimental Botany. 67 (2): 489–94. doi:10.1093 / jxb / erv467. PMID 26507892.
- ^ A b He Z, He D, Kohorn BD (01.04.1998). "Požadavek na indukovanou expresi receptorové kinázy asociované s buněčnou stěnou pro přežití během patogenní reakce". The Plant Journal. 14 (1): 55–63. doi:10.1046 / j.1365-313x.1998.00092.x. PMID 9681026.
