Thionyl tetrafluorid - Thionyl tetrafluoride
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Thionyl tetrafluorid | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| SOF4 | |||
| Vzhled | bezbarvý plyn | ||
| Hustota | 1,653-0,0036T (° C) kapalina[1] | ||
| Bod tání | -99,6 ° C (-147,3 ° F; 173,6 K) | ||
| Bod varu | −49 ° C (−56 ° F; 224 K) 5090 cal / mol odpařovacího tepla[1] | ||
| reakce ve vodě | |||
| log P | 7,2349 - 859,58 / T - 26275 / T²[1] | ||
| Struktura | |||
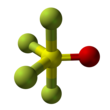
| zkreslený trigonální bipyramid | |||
| Nebezpečí | |||
| R-věty (zastaralý) | R36 / 37/38[2] | ||
| Související sloučeniny | |||
Související oxohalidy | Thionylfluorid Selenyl tetrafluorid | ||
Související sloučeniny | Fosforyltrifluorid pentafluorosulfur hypofluorit sulfurylfluorid | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Thionyl tetrafluorid je anorganická sloučenina plyn s vzorec SÓF4. Je také známý jako oxid tetrafluorid sírový. Tvar molekuly je zkreslený trigonální bipyramid a kyslík se nachází na rovníku. Atomy na rovníku mají kratší délky vazeb než atomy fluoru na ose. Vazba síry a kyslíku je 1,409 Á. Vazba S-F na ose má délku 1,596Å a vazba S-F na rovníku má délku 1,539Å. Úhel mezi rovníkovými atomy fluoru je 112,8 °. Úhel mezi axiálním fluorem a kyslíkem je 97,7 °. Úhel mezi kyslíkem a rovníkovým fluorem je 123,6 ° a mezi axiálním a rovníkovým fluorem je 85,7 °.[3] Atomy fluoru produkují pouze jeden NMR linka, pravděpodobně proto, že směnné pozice.[1]
Formace
Thionylfluorid reagovat s fluor plyn může produkovat thionyltetrafluorid.[1] Takto plyn poprvé objevili Moissan a Lebeau v roce 1902. Vzorec identifikovali podle změn tlaku vyplývajících z reakce. Fluorid stříbrný a Platina jsou schopné katalyzovat reakci.
Může být také vytvořen zahřátím fluorid sírový se vzduchem do 400 °.[4] To se může stát při vdechování přes zapálenou cigaretu. Nebo reakce difluorid stříbrný s thionylfluoridem při 200 stupních.[5] Dalším způsobem, jak jej vytvořit, je elektrolyzování fluorovodík s řešením oxid siřičitý, který také udělal difluorid kyslíku a sulfurylfluorid.[6] Taky thionylchlorid nebo thionylfluorid elektrolyzovaný fluorovodíkem produkoval ještě více plynu.
Reakce
Thionyltetrafluorid reaguje s vodou za vzniku kyselina fluorovodíková, kyselinu sírovodíkovou, a sulfuryl difluorid. Rtuť může odstranit fluorid, aby vytvořil thionylfluorid a rtuťnatý fluorid. Silné zásady vedou k tvorbě fluoridů a fluorosíran ionty.[1]
Klikněte na chemii
Thionyl tetrafluorid lze použít v klikněte na chemii prostřednictvím reakcí s primárními aminy známými jako výměna fluoridů síry (VI) (SuFEx).[7] Tento druh reakce byl první reakcí „kliknutí“, která vygenerovala trojrozměrné jádro.
Reference
- ^ A b C d E F Harry Julius Emeléus a A.G. Sharpe Advances in Anorganic Chemistry Volume 2 Academic Press 1960 strana 117 [1]
- ^ „Bezpečnostní údaje pro thionyltetrafluorid“. Oxfordská univerzita. 02.09.2005. Citováno 2008-07-29.
- ^ Lise Hedberg a Kenneth Hedberg "Thionyl tetrafluorid. Reanalýza molekulární struktury a řešení problému s více modely" Journal of Physical Chemistry Březen 1982, svazek 86, strana 598 doi 10.1021 / j100394a004 [2]
- ^ „Vlastnosti plynu SF6“.
- ^ Dudley, F. B. (1956). „Pentafluorosulfur Hypofluorite and Thionyl Tetrafluoride“. Journal of the American Chemical Society. 78 (8): 1553–1557. doi:10.1021 / ja01589a013.
- ^ Shunji Nagase fluorace anorganických sloučenin síry Bulletin of the Chemical Society of Japan vol 42 strana 2062 1968
- ^ Li, Suhua; Wu, Peng; Mojžíš, John E .; Sharpless, K. Barry (01.02.2017). „Multidimenzionální chemie SuFEx Click: Spojení sekvenčních fluorů a fluoridů u různých modulů spuštěná z rozbočovače SOF4“. Angewandte Chemie International Edition. 56 (11): 2903–2908. doi:10.1002 / anie.201611048. ISSN 1521-3773. PMC 5434761. PMID 28165188.