Staurosporin - Staurosporine
 | |
 | |
| Klinické údaje | |
|---|---|
| ATC kód |
|
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| ChEBI | |
| ChEMBL | |
| PDB ligand | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.109.946 |
| Chemické a fyzikální údaje | |
| Vzorec | C28H26N4Ó3 |
| Molární hmotnost | 466.541 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
| | |
Staurosporin (antibiotikum AM-2282 nebo STS) je a přírodní produkt původně izolován v roce 1977 z bakterie Streptomyces staurosporeus.[1]Byla to první z více než 50 alkaloidy být izolován tímto typem bis-indolové chemické struktury. Chemická struktura staurosporinu byla objasněna rentgenovou analýzou monokrystalu a absolutní stereochemickou konfigurací stejnou metodou v roce 1994.[2]
Bylo zjištěno, že staurosporin má biologické aktivity od antifungálních po antihypertenzní.[3]Zájem o tyto aktivity vyústil ve velké výzkumné úsilí v chemii a biologii a objev potenciálu protinádorové léčby.
Biologické aktivity
Hlavní biologickou aktivitou staurosporinu je inhibice z proteinové kinázy prevencí vazby ATP na kinázu. Toho je dosaženo silnější afinitou staurosporinu k vazebnému místu ATP na kináze. Staurosporin je prototypem ATP-kompetitivního inhibitoru kinázy v tom, že se váže na mnoho kináz s vysokou afinitou, i když s malou selektivitou.[4] Strukturální analýza kinázových kapes prokázala, že atomy hlavních řetězců, které jsou konzervovány v jejich relativních polohách ke staurosporinu, přispívají k promiskuitě staurosporinu.[5] Tato nedostatečná specifičnost vyloučila jeho klinické použití, ale učinila z něj cenný výzkumný nástroj. Ve výzkumu se staurosporin používá k indukci apoptóza. Mechanismus, jak to zprostředkovává, není dobře znám. Bylo zjištěno, že jedním ze způsobů, jak staurosporin indukuje apoptózu, je aktivace kaspáza-3.[6] Při nižší koncentraci, v závislosti na typu buňky, vyvolává staurosporin specifické účinky na buněčný cyklus, které zastavují buňky buď v G1 nebo v G2 fáze buněčného cyklu.[7]
Rodina chemie
Staurosporin je indolokarbazol. Patří k nejčastěji izolované skupině indolokarbazolů: Indolo (2,3-a) karbazoly. Z nich patří staurosporin do nejběžnější podskupiny zvané indolo (2,3-a) pyrrol (3,4-c) karbazoly. Spadají do dvou tříd - halogenovaných (chlorovaných) a nehalogenovaných. Halogenované indolo (2,3-a) pyrrol (3,4-c) karbazoly mají plně oxidovaný uhlík C-7 pouze s jedním indolovým dusíkem obsahujícím β-glykosidovou vazbu, zatímco nehalogenovaný indolo (2,3-a) pyrrol (3,4-c) karbazoly mají glykosylované indolnitrogeny a plně redukovaný uhlík C-7. Staurosporin je v nehalogenované třídě.[8]
Staurosporin je předchůdcem románu inhibitor proteinkinázy midostaurin (PKC412).[9][10] Kromě midostaurinu se staurosporin také používá jako výchozí materiál v komerční syntéze K252c (nazývaný také staurosporin aglykon). V přírodní biosyntetické dráze je K252c prekurzorem staurosporinu.


Biosyntéza
Biosyntéza staurosporinu začíná aminokyselinou L-tryptofan v jeho zwitterionický formulář. Tryptofan se převádí na já těžím enzymem StaO, což je oxidáza L-aminokyseliny (která může být závislá na FAD). Na imin působí StaD za vzniku necharakterizovaného meziproduktu navrženého jako produkt dimerizace mezi 2 molekulami iminu. Kyselina chromopyrrolová je molekula vytvořená z tohoto meziproduktu po ztrátě VioE (používá se při biosyntéze violaceinu - přírodního produktu vytvořeného z bodu rozvětvení v této cestě, který se také rozchází a tvoří rebeccamycin. Arylová arylová vazba, o které se předpokládá, že je katalyzována a cytochrom P450 nastává enzym za vzniku aromatického kruhového systému.[8]
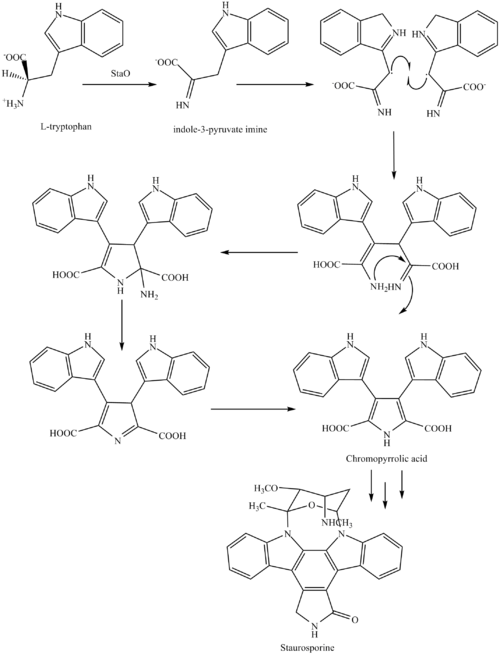
Poté následuje a nukleofilní útok mezi indolovými dusíky, což vede k cyklizaci a poté dekarboxylace za pomoci StaC výhradně za tvorby staurosporinového aglykonu nebo K252c. Glukóza se transformuje na NTP-L-ristoamin pomocí StaA / B / E / J / I / K, který se poté přidá ke staurosporinovému aglykonu v 1 indolu N pomocí StaG. Enzym StaN přeorientuje cukr připojením k dusíku druhého indolu do nepříznivé konformace za vzniku zprostředkovaného O-demethyl-N-demethyl-staurosporinu. A konečně, O-methylace 4'aminu pomocí StaMA a N-methylace 3'-hydroxy pomocí StaMB vede k tvorbě staurosporinu.[8]
Výzkum v klinickém použití
Při zapouzdření v liposom nanočástice Ukázalo se, že staurosporin potlačuje nádory in vivo v myším modelu bez toxických vedlejších účinků, které zakazují jeho použití jako protinádorového léčiva s vysokou apoptotickou aktivitou. Výzkumní pracovníci v UC San Diego Moores Cancer Center vyvinout platformovou technologii s vysokou účinností zavádění léků manipulací s pH prostředí buněk. Při injekci do myši glioblastom modelu se zjistilo, že staurosporin se hromadí primárně v nádoru prostřednictvím fluorescence potvrzení a myši neutrpěly úbytek hmotnosti ve srovnání s kontrolními myšmi, kterým byla podávána volná sloučenina, což je indikátor snížené toxicity.[11][12]
Reference
- ^ Omura S, Iwai Y, Hirano A, Nakagawa A, Awaya J, Tsuchiya H, Takahashi Y, Masuma R (1977). „Nový alkaloid AM-2282 taxonomie původu Streptomyces, fermentace, izolace a předběžná charakterizace“. J. Antibiot. 30 (4): 275–282. doi:10,7164 / antibiotika. 30,275. PMID 863788.
- ^ Funato N, Takayanagi H, Konda Y, Toda Y, Harigaya Y, Omura S (1994). "Absolutní konfigurace staurosporinu rentgenovou analýzou". Tetrahedron Lett. 35 (8): 1251–1254. doi:10.1016/0040-4039(94)88036-0.
- ^ [1] Rüegg UT, Burgess GM. (1989) Staurosporin, K-252 a UCN-01: silné, ale nespecifické inhibitory proteinových kináz. Trendy ve farmakologické vědě 10 (6): 218-220.
- ^ Karaman MW, Herrgard S, Treiber DK, Gallant P, Atteridge CE, Campbell BT, Chan KW, Ciceri P, Davis MI, Edeen PT, Faraoni R, Floyd M, Hunt JP, Lockhart DJ, Milanov ZV, Morrison MJ, Pallares G , Patel HK, Pritchard S, Wodicka LM, Zarrinkar PP (2008). "Kvantitativní analýza selektivity inhibitoru kinázy". Nat. Biotechnol. 26 (1): 127–132. doi:10.1038 / nbt1358. PMID 18183025. S2CID 205273598.
- ^ Tanramluk D, Schreyer A, Pitt WR, Blundell TL (2009). „K počátkům selektivity a promiskuity inhibitorů enzymů: případová studie vazby protein kinázy na staurosporin“. Chem. Biol. Drug Des. 74 (1): 16–24. doi:10.1111 / j.1747-0285.2009.00832.x. PMC 2737611. PMID 19519740.
- ^ Chae HJ, Kang JS, Byun JO, Han KS, Kim DU, Oh SM, Kim HM, Chae SW, Kim HR (2000). „Molekulární mechanismus apoptózy vyvolané staurosporinem v osteoblastech“. Farmakologický výzkum. 42 (4): 373–381. doi:10,1006 / phrs.2000.0700. PMID 10987998.
- ^ Bruno S, Ardelt B, Skierski JS, Traganos F, Darzynkiewicz Z (1992). "Různé účinky staurosporinu, inhibitoru proteinových kináz, na buněčný cyklus a chromatinovou strukturu normálních a leukemických lymfocytů". Cancer Res. 52 (2): 470–473. PMID 1728418.
- ^ A b C Ryan KS (2008). „Strukturální studie biosyntetických enzymů rebeccamycinu, staurosporinu a violaceinu“ (PDF). Ph.D. Teze. Massachusetts Institute of Technology. Archivovány od originál (PDF) dne 14.03.2012.
- ^ Midostaurin stránka produktu, Fermentek
- ^ Wang, Y; Yin, OQ; Graf, P; Kisicki, JC; Schran, H (2008). „Dávková a časově závislá farmakokinetika midostaurinu u pacientů s diabetes mellitus“. J Clin Pharmacol. 48 (6): 763–775. doi:10.1177/0091270008318006. PMID 18508951.
- ^ Tisková zpráva (21. října 2013). „Studie identifikuje bezpečný doručovací systém pro složité, ale vysoce účinné protirakovinové sloučeniny“. UC San Diego Health System. Citováno 27. října 2013.
- ^ Mukthavaram, Rajesh; Jiang, Pengei; Saklecha, Rohit; Simbery, Dmitri; Bharati, Ila; Nomura, Natsuko; Chao, Ying; Pastorino, Sandra (2013). „Vysoce účinná liposomální enkapsulace inhibitoru tyrosinkinázy vede ke zlepšení in vivo toxicity a profilu odpovědi nádoru“. International Journal of Nanomedicine. 8 (1): 3991–4006. doi:10.2147 / IJN.S51949. PMC 3808212. PMID 24174874.
