N-Bromosukcinimid - N-Bromosuccinimide - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC 1-Brom-2,5-pyrrolidindion | |||
| Ostatní jména N-bromsukcinimid; NBS | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 113916 | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.004.435 | ||
| Číslo ES |
| ||
| 26634 | |||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H4BrNÓ2 | |||
| Molární hmotnost | 177.985 g · mol−1 | ||
| Vzhled | Bílá pevná látka | ||
| Hustota | 2,098 g / cm3 (pevný) | ||
| Bod tání | 175 až 178 ° C (347 až 352 ° F; 448 až 451 K) | ||
| Bod varu | 339 ° C (642 ° F; 612 K) | ||
| 14,7 g / l (25 ° C) | |||
| Rozpustnost v CCl4 | Nerozpustný (25 ° C) | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Dráždivý | ||
| Bezpečnostní list | [1] | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
N-Bromosukcinimid nebo NBS je chemické činidlo použito v radikální substituce, elektrofilní adice, a elektrofilní substituce reakce v organická chemie. NBS může být vhodným zdrojem Br•, bróm radikální.
Příprava
NBS je komerčně dostupná. Může být také syntetizován v laboratoři. Udělat to tak, hydroxid sodný a brom se přidají k roztoku ledu a vody sukcinimid. Produkt NBS sráží a lze je sbírat filtrací.[1]
Surová NBS poskytuje lepší výnos v EU Wohl-Zieglerova reakce. V ostatních případech může nečistý NBS (světle žluté barvy) poskytnout nespolehlivé výsledky. Může být čištěn rekrystalizací z vody 90–95 ° C (10 g NBS na 100 ml vody).[2]
Reakce
Přídavek k alkenům
NBS bude reagovat s alkeny 1 ve vodných rozpouštědlech bromohydriny 2. Výhodnými podmínkami je částečné přidání NBS k roztoku alkenu v 50% vodném roztoku DMSO, DME, THF nebo tert-butanol při 0 ° C.[3] Vznik a bromoniový ion a okamžitý útok vodou dává silný Doplněk Markovnikov a proti stereochemické selektivity.[4]
Mezi vedlejší reakce patří tvorba a-bromketonů a dibromových sloučenin. Ty lze minimalizovat čerstvým použitím překrystalováno NBS.
S přidáním nukleofily, namísto voda lze syntetizovat různé bifunkční alkany.[5]
Allylová a benzylová bromace
Standardní podmínky pro použití NBS v allylové a / nebo benzylové bromace zahrnuje refluxování roztoku NBS v bezvodý CCl4 s radikálním iniciátorem - obvykle azobisisobutyronitrilem (AIBN ) nebo benzoylperoxid ozařování nebo obojí radikální zahájení.[6][7] Allylové a benzylové radikály, vytvořené během této reakce, jsou stabilnější než jiné uhlíkové radikály a hlavními produkty jsou allylové a benzylbromidy. Tomu se také říká Wohl – Zieglerova reakce.[8][9]
The chlorid uhličitý musí být udržován bezvodý po celou dobu reakce, protože přítomnost voda pravděpodobně hydrolyzovat požadovaný produkt.[10] Uhličitan barnatý se často přidává k udržení bezvodých a bezkyselinových podmínek.
Ve výše uvedené reakci je možná směs isomerních allylbromidových produktů, ale pouze jeden je vytvořen kvůli větší stabilitě radikálu v poloze 4 nad radikálem se středem v methylu.
Bromace karbonylových derivátů
NBS může a-bromátovat karbonylové deriváty buď radikálovou cestou (jak je uvedeno výše), nebo pomocí kyselé katalýzy. Například, hexanoylchlorid 1 mohou být bromovány v alfa poloze NBS pomocí kyselé katalýzy.[11]
Reakce enoláty, enol ethery nebo enol acetáty s NBS je upřednostňovanou metodou a-bromace, protože je vysoce výnosná s několika vedlejšími produkty.[12][13]
Bromace aromatických derivátů
Bohatý na elektrony aromatický sloučeniny, jako jsou fenoly, aniliny a různé aromatické heterocykly,[14] lze bromovat pomocí NBS.[15][16] Použitím DMF protože rozpouštědlo poskytuje vysoké úrovně para-selektivity.[17]
Hofmannův přesmyk
NBS, v přítomnosti silné základny, jako je DBU, reaguje s primární amidy vyrábět karbamát přes Hofmannův přesmyk.[18]
Selektivní oxidace alkoholů
To je neobvyklé, ale je možné, že NBS oxiduje alkoholy. E. J. Corey et al. zjistil, že lze selektivně okysličovat sekundární alkoholy v přítomnosti primárních alkoholů za použití NBS ve vodném roztoku dimethoxyethan (DME).[19]
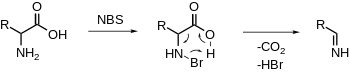
Oxidační dekarboxylace α-aminokyselin
NBS elektrofilně bromuje amin, po kterém následuje dekarboxylace a uvolnění iminu. Další hydrolýza poskytne aldehyd a amoniak.[20][21] (viz neoxidační dekarboxylace závislá na PLP)
Opatření
Přestože se s NBS manipuluje snáze a bezpečněji než s bromem, měla by být přijata preventivní opatření, aby se zabránilo vdechování. NBS by měl být skladován v chladničce. NBS se časem rozloží a uvolní brom. Čistý NBS je bílý, ale často se zjistí, že je šedobílý nebo hnědý barvou bromu.
Obecně jsou reakce zahrnující NBS exotermické. Při velkém použití by proto měla být přijata zvláštní opatření.
Viz také
Reference
- ^ Ziegler, K .; Späth, A. (1942). „Die Halogenierung ungesättigter Substanzen in der Allylstellungs“. Ann. Chem. 551 (1): 80–119. doi:10.1002 / jlac.19425510103.
- ^ Dauben, H. J., Jr.; McCoy, L. L. (1959). "N-Bromosukcinimid. I. Allylická bromace, obecný přehled reakčních proměnných “. J. Am. Chem. Soc. 81 (18): 4863–4873. doi:10.1021 / ja01527a027.
- ^ Hanzlik, R. P. „Selektivní epoxidace terminálních dvojných vazeb“. Organické syntézy.; Kolektivní objem, 6, str. 560
- ^ Beger, J. (1991). „Präparative Aspekte elektrophiler Dreikomponentenreaktionen mit Alkenen“ [Preparativní aspekty elektrofilních třísložkových reakcí s alkeny]. J. Prakt. Chem. 333 (5): 677–698. doi:10.1002 / prac.19913330502.
- ^ Haufe, G .; Alvernhe, G .; Laurent, A .; Ernet, T .; Goj, O .; Kröger, S .; Sattler, A. (2004). „Bromofluorace alkenů“. Organické syntézy.; Kolektivní objem, 10, str. 128
- ^ Djerassi, Carl (1948). „Brominace s N-Bromosukcinimid a související sloučeniny. Reakce Wohl – Ziegler “. Chem. Rev. 43 (2): 271–317. doi:10.1021 / cr60135a004. PMID 18887958.
- ^ Greenwood, F.L .; Kellert, M. D .; Sedlak, J. (1963). „4-Brom-2-heptene“. Organické syntézy.; Kolektivní objem, 4, str. 108
- ^ Wohl, A. (1919). „Bromierung ungesättigter Verbindungen mit N-Brom-acetamid, ein Beitrag zur Lehre vom Verlauf chemischer Vorgänge " [Bromace nenasycených sloučenin s N-bromacetamid, příspěvek k teorii průběhu chemických procesů]. Berichte der Deutschen Chemischen Gesellschaft (řada A a B). 52: 51–63. doi:10.1002 / cber.19190520109.
- ^ Ziegler, K .; Schenck, G .; Krockow, E. W .; Siebert, A .; Wenz, A .; Weber, H. (1942). „Die Synthese des Cantharidins“ [Syntéza kantharidinu]. Justnal Liebig's Annalen der Chemie. 551: 1–79. doi:10.1002 / jlac.19425510102.
- ^ Binkley, R. W .; Goewey, G. S .; Johnston, J. (1984). "Regioselektivní otevření kruhu vybraných benzylidenacetálů. Fotochemicky iniciovaná reakce pro částečnou deprotekci sacharidů". J. Org. Chem. 49 (6): 992. doi:10.1021 / jo00180a008.
- ^ Harpp, D. N .; Bao, L. Q .; Coyle, C .; Gleason, J. G .; Horovitch, S. (1988). „2-Bromhexanoylchlorid“. Organické syntézy.; Kolektivní objem, 6, str. 190
- ^ Stotter, P.L .; Hill, K. A. (1973). "α-Halokarbonylové sloučeniny. II. Pozičně specifická příprava a-bromketonů bromací lithiových enolátů. Pozičně specifické zavedení a, β-nenasycení do nesymetrických ketonů". J. Org. Chem. 38 (14): 2576. doi:10.1021 / jo00954a045.
- ^ Lichtenthaler, F. W. (1992). "Různí dárci glykosylu s funkcí ketonu nebo oximu vedle anomerického centra: snadná příprava a hodnocení jejich selektivity v glykosidacích". Syntéza. 1992: 179–84. doi:10.1055 / s-1992-34167.
- ^ Amat, M .; Hadida, S .; Sathyanarayana, S .; Bosc, J. (1998). "Regioselektivní syntéza 3-substituovaných indolů". Organické syntézy.; Kolektivní objem, 9, str. 417
- ^ Gilow, H. W .; Burton, D. E. (1981). "Bromace a chlorace pyrrolu a některých reaktivních 1-substituovaných pyrrolů". J. Org. Chem. 46 (11): 2221. doi:10.1021 / jo00324a005.
- ^ Brown, W. D .; Gouliaev, A. H. (2005). "Syntéza 5-bromisochinolinu a 5-brom-8-nitroisochinolinu". Organické syntézy. 81: 98.
- ^ Mitchell, R. H .; Lai, Y. H .; Williams, R. V. (1979). "N-Bromosukcinimid-dimethylformamid: mírné, selektivní nukleární monobromační činidlo pro reaktivní aromatické sloučeniny. “ J. Org. Chem. 44 (25): 4733. doi:10.1021 / jo00393a066.
- ^ Keillor, J. W .; Huang, X. (2004). „Tvorba methylkarbamátu prostřednictvím modifikovaných přeskupovacích reakcí Hofmann“. Organické syntézy.; Kolektivní objem, 10, str. 549
- ^ Corey, E. J.; Ishiguro, M (1979). "Celková syntéza (±) -2-isokyanopupukeananu". Tetrahedron Lett. 20 (30): 2745–2748. doi:10.1016 / S0040-4039 (01) 86404-2.
- ^ Ramachandran, M. S .; Easwaramoorthy, D .; Rajasingh, V .; Vivekanandam, T. S. (01.01.1990). "N-Chlorsukcinimidem podporovaná oxidativní dekarboxylace α-aminokyselin ve vodném alkalickém prostředí ". Bulletin of the Chemical Society of Japan. 63 (8): 2397–2403. doi:10,1246 / bcsj.63.2397.
- ^ Song, Xuezheng; Ju, Hong; Zhao, Chunmei; Lasanajak, Yi (2014-10-15). "Nová strategie k vydání a označení N-Glykany pro funkční glykomiku ". Chemie biokonjugátu. 25 (10): 1881–1887. doi:10.1021 / bc500366v. ISSN 1043-1802. PMC 4197647. PMID 25222505.