Izoforon - Isophorone - Wikipedia
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC 3,5,5-trimethylcyklohex-2-en-1-on | |
| Ostatní jména 3,5,5-trimethyl-2-cyklohexen-l-on 1,1,3-Trimethyl-3-cyklohexen-5-on Isoforon Isoacetoforon IP | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.001.024 |
| Číslo ES |
|
| KEGG | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C9H14Ó | |
| Molární hmotnost | 138.210 g · mol−1 |
| Vzhled | Bezbarvá až bílá kapalina |
| Zápach | Máta máta[2] |
| Hustota | 0,9255 g / cm3 |
| Bod tání | -8,1 ° C (17,4 ° F; 265,0 K) |
| Bod varu | 215,32 ° C (419,58 ° F; 488,47 K) |
| 1,2 g / 100 ml | |
| Rozpustnost | éter, aceton, hexan, dichlormethan, benzen, toluen, alkohol |
| Tlak páry | 0,3 mmHg (20 ° C)[2] |
Index lomu (nD) | 1.4766 |
| Viskozita | 2,62 cP |
| Termochemie | |
Std entalpie of formace (ΔFH⦵298) | 43,4 kJ / mol |
| Nebezpečí | |
| Bod vzplanutí | 84 ° C (183 ° F; 357 K) |
| 460 ° C (860 ° F; 733 K) | |
| Výbušné limity | 0.8–3.8%[2] |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 2280 mg / kg (potkan, orální)[Citace je zapotřebí ] 2330 mg / kg (potkan, orální) 2690 mg / kg (myš, orální)[3] |
LC50 (střední koncentrace ) | 4600 ppm (morče, 8 hodin)[3] |
LChle (nejnižší publikováno ) | 885 ppm (krysa, 6 hodin) 1840 ppm (krysa, 4 hodiny)[3] |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | PEL (časově vážený průměr) 25 ppm (140 mg / m3)[2] |
REL (Doporučeno) | TWA 4 ppm (23 mg / m3)[2] |
IDLH (Okamžité nebezpečí) | 200 ppm[2] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Izoforon je a, β-nenasycený cyklický keton. Je to bezbarvá kapalina s charakteristickým zápachem máty peprné, ačkoli komerční vzorky mohou vypadat nažloutlé. Používá se jako solventní a jako předchůdce polymerů se průmyslově vyrábí ve velkém měřítku.[4]
Struktura a reaktivita
Izoforon prochází reakcemi charakteristickými pro α, β-nenasycený keton. Hydrogenací se získá derivát cyklohexanonu. Epoxidace s bazickou peroxid vodíku poskytuje oxid.[5]
Izoforon je degradován útokem hydroxylové radikály.[6]
Fotodimerizace
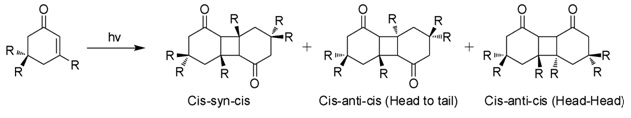
Při působení slunečního záření ve vodných roztocích podléhá izoforon 2 + 2 fotocitlivost dát tři izomerní fotodimery (obrázek). Tyto "diketomery" jsou cis-syn-cis, hlava po ocas (HT), cys-anti-cys (HT) a hlava-hlava (HH). Tvorba HH fotodimerů je upřednostňována před HT fotodimery se zvyšující se polaritou média.[7]
Přirozený výskyt
Izoforon se přirozeně vyskytuje v brusinky. [8]
Syntéza
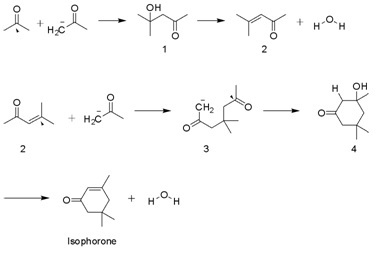
Izoforon vyrábí v mnohotisícovém měřítku kondenzace aldolu z aceton pomocí KOH. Diacetonový alkohol, mesityloxid a 3-hydroxy-3,5,5-trimethylcyklohexan-l-on jsou meziprodukty. Vedlejší produkt je beta-izoforon, kde skupina C = C není konjugována s ketonem.[4]
Aplikace
Částečně hydrogenovaný derivát trimethylcyklohexanon se používá při výrobě polykarbonáty. Kondenzuje s fenolem za vzniku analogu bisfenol A. Polykarbonáty vyrobené fosgenací těchto dvou diolů produkují polymer se zlepšenou tepelnou stabilitou.[9] Trimethylkyselina adipová a 2,2,4-trimethylhexamethylendiamin se vyrábějí z trimethylcyklohexanonu a trimethylcyklohexanolu. Používají se k výrobě specialit polyamidy. Hydrocyanace poskytuje nitril, následovaný redukční aminací isoforon diamin. Tento diamin se používá k výrobě isoforon diisokyanát který má určité specializované aplikace.[4]

Plná hydrogenace dává 3,3,5-trimethylcyklohexanol, předchůdce opalovacích krémů i chemických zbraní.
Bezpečnost
Hodnota LD50 isoforonu u potkanů a králíků při orální expozici je kolem 2,00 g / kg.[10] Bezpečnostní aspekty izoforonu byly předmětem několika studií.[11]
Dějiny
Použití isoforonu jako rozpouštědla bylo výsledkem hledání způsobů, jak se zbavit nebo recyklovat aceton, což je odpadní produkt z fenol syntéza pomocí Hockova metoda.[12]
Viz také
Reference
- ^ Index společnosti Merck, 13. vydání, 5215.
- ^ A b C d E F NIOSH Kapesní průvodce chemickými nebezpečími. "#0355". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b C "Isoforon". Koncentrace bezprostředně nebezpečné pro život a zdraví (IDLH). Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ A b C Hardo Siegel, Manfred Eggersdorfer (2005). "Ketony". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a15_077. ISBN 9783527306732.CS1 maint: používá parametr autoři (odkaz)
- ^ Richard L. Wasson, Herbert O. House (1957). „Isoforon Oxide“. Org. Synth. 37: 58. doi:10.15227 / orgsyn.037.0058.CS1 maint: používá parametr autoři (odkaz)
- ^ „TOXNET“. toxnet.nlm.nih.gov. Archivovány od originál dne 2017-10-24. Citováno 2016-03-11.
- ^ Gonçalves, Huguette; Robinet, Germaine; Barthelat, Michèle; Lattes, Armand (1998-01-28). „Supramolekulárnost a fotodimerizace izoforonu: FTIR a studie molekulární mechaniky“. The Journal of Physical Chemistry A. 102 (8): 1279–1287. doi:10.1021 / jp9729270.
- ^ [1]
- ^ Volker Serini (2000). "Polykarbonáty". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a21_207. ISBN 978-3527306732.CS1 maint: používá parametr autoři (odkaz)
- ^ „Účinky toxicity“. tools.niehs.nih.gov. Citováno 2016-03-11.
- ^ W. Morton Grant, Joel S. Schuman M.D (11. února 2016). "Toxikologie oka: Účinky na oči a vizuální systém z chemických látek, drog, kovů a minerálů, rostlin, toxinů a jedů; Rovněž systémové vedlejší účinky z oka". Med (2-Volume Set) 4th Edition, Strana 863.
- ^ Historie izoforonů v Degussa
