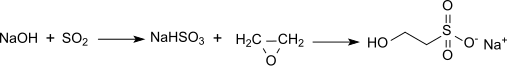Kyselina isethionová - Isethionic acid
 | |
 Kyselina isethionová | |
| Jména | |
|---|---|
| Název IUPAC 2-hydroxyethansulfonová kyselina | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.003.169 |
| KEGG | |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C2H6Ó4S | |
| Molární hmotnost | 126,13 g / mol |
| Hustota | 1,63 g / cm3 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
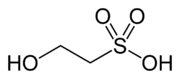
Kyselina isethionová je organosírná sloučenina obsahující alkylkyselina sulfonová nachází se beta na a hydroxyskupina. Jeho objev se obecně připisuje Heinrich Gustav Magnus, který jej připravil působením pevných látek oxid sírový na ethanol v roce 1833.[1]Je to bílá rozpustné ve vodě pevné látky používané při výrobě určitých povrchově aktivní látky a v průmyslové výrobě taurin. Nejběžněji je dostupný ve formě sodné soli (isethionát sodný ).
Syntéza
Jeho původní syntéza, reakcí oxid sírový na ethanol,[1] byl do značné míry překonán. Může být vyroben hydrolýzou karbylsulfát, který se získá sulfonací ethylen.
Nejběžnější cestou je však reakce ethylenoxid s vodným hydrogensiřičitan sodný, který produkuje sodnou sůl (isethionát sodný ):
Reakce
Kyselina isethionová se používá jako výchozí materiál při průmyslové výrobě taurin.
Dehydratace kyseliny isethionové dává kyselina vinylsulfonová.[2]
Deriváty
Mastné kyseliny estery kyseliny isethionové (např lauroylisethionát sodný a kokoylisethionát sodný ) se používají jako biologicky odbouratelný aniontový povrchově aktivní látky.[3] Tyto materiály jsou mnohem šetrnější k pokožce než jiné povrchově aktivní látky na bázi síranu (tj. laurylsulfát sodný )[4] což je činí oblíbenými pro líčení, šampony a mýdlové tyčinky typu „Dove type“.
Kyselina isethionová se také používá jako a protiion v některých farmaceutických formulace, včetně antimikrobiální látky hexamidin a pentamidin.[5]
Biologický význam
Studie provedené na plátcích srdce psa naznačují, že srdeční tkáň může být schopná přeměny taurin na kyselinu isethionovou další experimenty prokázaly, že tato tkáň může syntetizovat taurin cystin.[6]
Viz také
Reference
- ^ A b Magnus, G. (1833). „Ueber die Weinschwefelsäure, ihren Einfluss auf die Aetherbildung, und über zwei neue Säuren ähnlicher Zusammensetzung“ (PDF). Annalen der Physik und Chemie. 103 (2): 367–388. doi:10.1002 / a p. 18331030213. ISSN 0003-3804.
- ^ Kosswig, Kurt (2000). "Kyseliny sulfonové, alifatické". Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002 / 14356007.a25_503. ISBN 3-527-30673-0.
- ^ Petter, P. J. (1984). "Sulfoalkylamidy a estery mastných kyselin jako kosmetické povrchově aktivní látky". International Journal of Cosmetic Science. 6 (5): 249–260. doi:10.1111 / j.1467-2494.1984.tb00382.x. ISSN 0142-5463.
- ^ Tupker, R. A .; Bunte, E. E.; Fidler, V .; Wlechers, J. W .; Coenraads, P. J. (1999). „Hodnocení dráždivosti aniontových detergentů pomocí jednorázových okluzivních, opakovaných okluzivních a opakovaných otevřených testů“. Kontaktujte dermatitidu. 40 (6): 316–322. doi:10.1111 / j.1600-0536.1999.tb06082.x. ISSN 0105-1873.
- ^ Wicho, H, ed. (2009). Rakousko-Codex Stoffliste (v němčině) (42 ed.). Vídeň: Österreichischer Apothekerverlag.
- ^ W. Read a J. D. Welty (1961). "Syntéza taurinu a kyseliny isethionové plátky srdce psa". The Journal of Biological Chemistry. 237: 1521–1522.