Glutaminolýza - Glutaminolysis
Glutaminolýza (glutamin + -lýza ) je řada biochemických reakcí, kterými se aminokyselina glutamin je lyžoval na glutamát, aspartát, CO2, pyruvát, laktát, alanin a citrát.[1][2][3][4][5][6][7][8][9][10][11][12][13][14][15][16][17][18][19][20]
Glutaminolytická cesta
Glutaminolýza částečně získává reakční kroky z cyklus kyseliny citronové a malát-aspartát raketoplán.
Reakční kroky od glutaminu po α-ketoglutarát
Konverze aminokyseliny glutaminu na α-ketoglutarát probíhá ve dvou reakčních krocích:
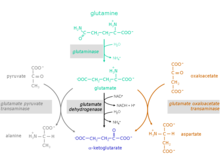
1. Hydrolýza aminoskupiny glutaminu za vzniku glutamátu a amonný Katalyzující enzym: glutamináza (EC 3.5.1.2)
2. Glutamát může být vylučován nebo může být dále metabolizován na α-ketoglutarát.
Pro přeměnu glutamátu na α-ketoglutarát jsou možné tři různé reakce:
Katalyzující enzymy:
- glutamát dehydrogenáza (GlDH), EC 1.4.1.2
- glutamát pyruvát transamináza (GPT), nazývaný také alanin transamináza (ALT), EC 2.6.1.2
- glutamát oxaloacetát transamináza (GOT), nazývaný také aspartát transamináza (AST), EC 2.6.1.1 (složka malátového aspartátového raketoplánu)
Rekrutované reakční kroky cyklu kyseliny citronové a malát aspartátového člunku

- α-ketoglutarát + NAD+ + CoASH → sukcinyl-CoA + NADH + H+ + CO2
katalyzující enzym: komplex α-ketoglutarát dehydrogenázy
- sukcinyl-CoA + GDP + Pi → sukcinát + GTP
katalyzující enzym: sukcinyl-CoA-syntetáza, EC 6.2.1.4
- sukcinát + FAD → fumarát + FADH2
katalyzující enzym: sukcinát dehydrogenáza, EC 1.3.5.1
- fumarát + H2O → malát
katalyzující enzym: fumaráza, EC 4.2.1.2
- malát + NAD+ → oxaloacetát + NADH + H+
katalyzující enzym: malát dehydrogenáza, EC 1.1.1.37 (složka malát aspartátového raketoplánu)
- oxaloacetát + acetyl-CoA + H2O → citrát + CoASH
katalyzující enzym: citrát syntáza, ES 2.3.3.1
Reakční kroky od malátu po pyruvát a laktát
Konverze malátu na pyruvát a laktát je katalyzována
- Malát dekarboxyláza závislá na NAD (P) (jablečný enzym; EC 1.1.1.39 a 1.1.1.40) a
- laktátdehydrogenáza (LDH; EC 1.1.1.27)
podle následujících rovnic:
- malát + NAD (P)+→ pyruvát + NAD (P) H + H+ + CO2
- pyruvát + NADH + H+ → laktát + NAD+
Intracelulární rozčlenění glutaminolytické dráhy
Reakce glutaminolytické dráhy probíhají částečně v mitochondriích a do jisté míry v cytosolu (srovnej metabolické schéma glutaminolytické dráhy).
Glutaminolýza: důležitý zdroj energie v nádorových buňkách
Glutaminolýza probíhá ve všech proliferujících buňkách,[21] jako lymfocyty, thymocyty, kolonocyty, adipocyty a zejména v nádor buňky.[1][2][3][4][5][6][7][8][10][11][12][13][14][16][18][19][22] V nádorových buňkách je cyklus kyseliny citronové zkrácen kvůli inhibici enzymu akonitáza (EC 4.2.1.3) vysokými koncentracemi reaktivní formy kyslíku (ROS)[23][24] Akonitáza katalyzuje přeměnu citrátu na isocitrát. Na druhé straně nádorové buňky nadměrně exprimují glutaminázu závislou na fosfátu a malát dekarboxylázu závislou na NAD (P),[9][25][26][27][28] které v kombinaci se zbývajícími reakčními kroky cyklu kyseliny citronové z α-ketoglutarátu na citrát propůjčují možnost nové cesty výroby energie, degradaci aminokyseliny glutamin na glutamát, aspartát, pyruvát CO2, laktát a citrát.
kromě glykolýza v nádorových buňkách je glutaminolýza dalším hlavním pilířem výroby energie. Vysoké koncentrace extracelulárního glutaminu stimulují růst nádoru a jsou nezbytné pro transformaci buněk.[27][29] Na druhé straně redukce glutaminu koreluje s fenotypovým a funkčním diferenciace buněk.[30]
Energetická účinnost glutaminolýzy v nádorových buňkách
- jeden ATP přímou fosforylací HDP
- dva ATP z oxidace FADH2
- tři ATP najednou pro NADH + H+ vznikající při reakci α-ketoglutarátdehydrogenázy, malátdehydrogenázové reakci a malát dekarboxylázové reakci.
Kvůli nízkým aktivitám glutamát dehydrogenázy a glutamát pyruvát-transaminázy dochází v nádorových buňkách k přeměně glutamátu na alfa-ketoglutarát hlavně prostřednictvím glutamát-oxaloacetát-transaminázy.[5][31]
Výhody glutaminolýzy v nádorových buňkách
- Glutamin je nejhojnější aminokyselinou v plazmě a dalším zdrojem energie v nádorových buňkách, zejména když je produkce glykolytické energie nízká kvůli vysokému množství dimerní forma M2-PK.
- Glutamin a jeho produkty degradace glutamát a aspartát jsou prekurzory nukleová kyselina a serin syntéza.
- Glutaminolýza je necitlivá na vysoké koncentrace reaktivních forem kyslíku (ROS).[Citace je zapotřebí ]
- Kvůli zkrácení cyklu kyseliny citronové množství acetyl-CoA infiltrovaný v cyklu kyseliny citronové je nízký a acetyl-CoA je k dispozici pro syntézu de novo mastné kyseliny a cholesterol. Mastné kyseliny mohou být použity pro syntézu fosfolipidů nebo mohou být uvolňovány.[32]
- Mastné kyseliny představují efektivní prostředek pro skladování vodíku. Uvolňování mastných kyselin je proto účinným způsobem, jak se zbavit cytosolického vodíku produkovaného v glykolytiku glyceraldehyd-3-fosfátdehydrogenáza (GAPDH; EC 1.2.1.9) reakce.[33]
- Glutamát a mastné kyseliny jsou imunosupresivní. Uvolňování obou metabolitů může chránit nádorové buňky před imunitními útoky.[34][35][36]
- Bylo diskutováno, že směs glutamátu může řídit endergonickou absorpci dalších aminokyselin systémem ASC.[17]
- Glutamin lze převést na citrát bez produkce NADH, čímž se oddělí produkce NADH od biosyntézy.[21]
Viz také
cyklus kyseliny citronové,malát-aspartát raketoplán
Reference
- ^ A b Krebs, HA; Bellamy D (1960). „Interkonverze kyseliny glutamové a kyseliny asparagové v dýchajících tkáních“. The Biochemical Journal. 75 (3): 523–529. doi:10.1042 / bj0750523. PMC 1204504. PMID 14411856.
- ^ A b Reitzer, LJ; Wice BM; Kennell D (1979). „Důkazy, že glutamin, nikoli cukr, je hlavním zdrojem energie pro kultivované HeLa-buňky“. The Journal of Biological Chemistry. 254 (8): 2669–2676. PMID 429309.
- ^ A b Zielke, HR; Sumbilla CM; Sevdalian DA; Hawkins RL; Ozand PT (1980). "Laktát: hlavní produkt metabolismu glutaminu v lidských diploidních fibroblastech". Journal of Cellular Physiology. 104 (3): 433–441. doi:10.1002 / jcp.1041040316. PMID 7419614.
- ^ A b Mc Keehan, WL (1982). "Glykolýza, glutaminolýza a buněčná proliferace". Cell Biology International Reports. 6 (7): 635–650. doi:10.1016/0309-1651(82)90125-4. PMID 6751566.
- ^ A b C Moreadith RW, RW; Lehninger AL (1984). „Cesty oxidace glutamátu a glutaminu mitochondriemi nádorových buněk“. The Journal of Biological Chemistry. 259 (10): 6215–6221. PMID 6144677.
- ^ A b Zielke, HR; Zielke CL; Ozand PT (1984). „Glutamin: hlavní zdroj energie pro kultivované savčí buňky“. Sborník federace. 43 (1): 121–125. PMID 6690331.
- ^ A b Eigenbrodt, E; Fister P; Reinacher M (1985). "Nové pohledy na metabolismus sacharidů v nádorových buňkách". Regulace metabolismu sacharidů. 2. 141–179. ISBN 978-0-8493-5263-8.
- ^ A b Lanks, KW (1987). "Konečné produkty metabolismu glukózy a glutaminu buňkami L929". The Journal of Biological Chemistry. 262 (21): 10093–10097. PMID 3611053.
- ^ A b Board, M; Humm S; Newsholme EA (1990). „Maximální aktivity klíčových enzymů glykolýzy, glutaminolýzy, fosfátové dráhy pentózy a cyklu kyseliny trikarboxylové v normálních, neoplastických a potlačených buňkách“. The Biochemical Journal. 265 (2): 503–509. doi:10.1042 / bj2650503. PMC 1136912. PMID 2302181.
- ^ A b Medina, MA; Nunez de Castro I (1990). "Glutaminolýza a glykolýza interakce v proliferujících buňkách". International Journal of Biochemistry. 22 (7): 681–683. doi:10.1016 / 0020-711X (90) 90001-J. PMID 2205518.
- ^ A b Goossens, V; Grooten J; Fiers W (1996). "Oxidační metabolismus glutaminu. Modulátor reaktivní kyslíkem zprostředkovaná cytotoxicita faktoru nekrotizujícího nádory v buňkách fibrosarkomu L929". The Journal of Biological Chemistry. 271 (1): 192–196. doi:10.1074 / jbc.271.1.192. PMID 8550558.
- ^ A b Mazurek, S; Michel A; Eigenbrodt E (1997). "Vliv extracelulárního AMP na buněčnou proliferaci a metabolismus buněčných linií rakoviny prsu s vysokou a nízkou glykolytickou rychlostí". Journal of Biological Chemistry. 272 (8): 4941–4952. doi:10.1074 / jbc.272.8.4941. PMID 9030554.
- ^ A b Eigenbrodt, E; Kallinowski F; Ott M; Mazurek S; Vaupel P (1998). „Pyruvátkináza a interakce metabolismu aminokyselin a sacharidů v pevných nádorech“. Protinádorový výzkum. 18 (5A): 3267–3274. PMID 9858894.
- ^ A b Piva, TJ; McEvoy-Bowe E (1998). „Oxidace glutaminu v HeLa buňkách: role a kontrola zkrácených TCA cyklů v nádorových mitochondriích“. Journal of Cellular Biochemistry. 68 (2): 213–225. doi:10.1002 / (SICI) 1097-4644 (19980201) 68: 2 <213 :: AID-JCB8> 3.0.CO; 2-Y. PMID 9443077.
- ^ Mazurek, S; Eigenbrodt E; Selhání K; Steinberg P (1999). „Změny v glykolytických a glutaminolytických drahách po maligní transformaci oválních buněk jater potkana“. Journal of Cellular Physiology. 181 (1): 136–146. doi:10.1002 / (SICI) 1097-4652 (199910) 181: 1 <136 :: AID-JCP14> 3.0.CO; 2-T. PMID 10457361.
- ^ A b Mazurek, S; Zwerschke W; Jansen-Dürr P; Eigenbrodt E (2001). „Účinky onkoproteinu lidského papilomaviru HPV-16 E7 na glykolýzu a glutaminolýzu: role pyuvát kinázy typu M2 a komplexu glykolytického enzymu“. Biochemical Journal. 356 (Pt 1): 247–256. doi:10.1042/0264-6021:3560247. PMC 1221834. PMID 11336658.
- ^ A b Aledo, JC (2004). „Rozklad glutaminu v rychle se dělících buňkách: plýtvání nebo investice?“. BioEssays. 26 (7): 778–785. doi:10.1002 / bies.20063. PMID 15221859.
- ^ A b Rossignol, R; Gilkerson R; Aggeler R; Yamagata K; Remington SJ; Capaldi RA (2004). „Energetický substrát moduluje mitochondriální strukturu a oxidační kapacitu v rakovinných buňkách“. Výzkum rakoviny. 64 (3): 985–993. doi:10.1158 / 0008-5472.CAN-03-1101. PMID 14871829.
- ^ A b Mazurek, S (2007). "Energetický metabolome nádorových buněk". Bioenergetika molekulárního systému. 521–540. ISBN 978-3-527-31787-5.
- ^ DeBerardinis, RJ; Řekl N; Ditsworth D; Thompson CB (2008). „Cihla po cihle: metabolismus a růst nádorů“. Aktuální názor na genetiku a vývoj. 18 (1): 54–61. doi:10.1016 / j.gde.2008.02.003. PMC 2476215. PMID 18387799.
- ^ A b Fernandez-de-Cossio-Diaz, Jorge; Vazquez, Alexei (18. 10. 2017). „Meze aerobního metabolismu v rakovinných buňkách“. Vědecké zprávy. 7 (1): 13488. Bibcode:2017NatSR ... 713488F. doi:10.1038 / s41598-017-14071-r. ISSN 2045-2322. PMC 5647437. PMID 29044214.
- ^ Wolfrom, C; Kadhom N; Polini G; Poggi J; Moatti N; Gautier M (1989). „Glutaminová závislost fibroblastů lidské kůže: modulace hexóz“. Experimentální výzkum buněk. 183 (2): 303–318. doi:10.1016/0014-4827(89)90391-1. PMID 2767153.
- ^ Gardner, PR; Raineri I; Epstein LB; White CW (1995). „Superoxidový radikál a železo modulují aktivitu akonitázy v buňkách savců“. Journal of Biological Chemistry. 270 (22): 13399–13405. doi:10.1074 / jbc.270.22.13399. PMID 7768942.
- ^ Kim, KH; Rodriguez AM; Carrico PM; Melendez JA (2001). "Potenciální mechanismy pro inhibici růstu nádorových buněk pomocí manganu superoxid dismutázy". Antioxidanty a redoxní signalizace. 3 (3): 361–373. doi:10.1089/15230860152409013. PMID 11491650.
- ^ Matsuno, T; Goto I (1992). „Činnosti glutaminázy a glutamin syntetázy v lidských cirhotických játrech a hepatocelulárním karcinomu“. Výzkum rakoviny. 52 (5): 1192–1194. PMID 1346587.
- ^ Aledo JC, Segura JA, Medina MA, Alonso FJ, Núñez de Castro I, Márquez J (1994). "Exprese fosfátem aktivované glutaminázy během vývoje nádoru". FEBS Dopisy. 341 (1): 39–42. doi:10.1016 / 0014-5793 (94) 80236-X. PMID 8137919. S2CID 12702894.
- ^ A b Lobo C, Ruiz-Bellido MA, Aledo JC, Márquez J, Núñez De Castro I, Alonso FJ (2000). „Inhibice exprese glutaminázy antisense mRNA snižuje růst a tumorogenitu nádorových buněk“. Biochemical Journal. 348 (2): 257–261. doi:10.1042/0264-6021:3480257. PMC 1221061. PMID 10816417.
- ^ Mazurek, S; Grimm H; Oehmke M; Weisse G; Teigelkamp S; Eigenbrodt E (2000). „Nádor M2-PK a glutaminolytické enzymy v metabolickém posunu nádorových buněk“. Protinádorový výzkum. 20 (6D): 5151–5154. PMID 11326687.
- ^ Turowski, GA; Rashid Z; Hong F; Madri JA; Basson MD (1994). „Glutamin moduluje fenotyp a stimuluje proliferaci v lidských buněčných liniích rakoviny tlustého střeva“. Výzkum rakoviny. 54 (22): 5974–5980. PMID 7954430.
- ^ Spittler, A; Oehler R; Goetzinger P; Holzer S; Reissner CM; Leutmezer J; Rath V; Wrba F; Fuegger R; Boltz-Nitulescu G; Roth E (1997). „Nízké koncentrace glutaminu indukují fenotypovou a funkční diferenciaci myelomonocytických buněk U937“. The Journal of Nutrition. 127 (11): 2151–2157. doi:10.1093 / jn / 127.11.2151. PMID 9349841.
- ^ Matsuno, T (1991). "Cesta oxidace glutamátu a její regulace v linii HuH13 buněk lidského hepatomu". Journal of Cellular Physiology. 148 (2): 290–294. doi:10.1002 / jcp.1041480215. PMID 1679060.
- ^ Parlo, RA; Coleman PS (1984). „Zvýšená rychlost exportu citrátů z mitochondrií hepatomu bohatého na cholesterol. Zkrácený Krebsův cyklus a další metabolické důsledky mitochondriální membrány cholesterolu“. The Journal of Biological Chemistry. 259 (16): 9997–10003. PMID 6469976.
- ^ Mazurek, S; Grimm H; Boschek CB; Vaupel P; Eigenbrodt E (2002). „Pyruvátkináza typu M2: křižovatka v metabolomu nádoru“. British Journal of Nutrition. 87: S23 – S29. doi:10.1079 / BJN2001455. PMID 11895152.
- ^ Eck, HP; Drings P; Dröge W (1989). "Plazmatické hladiny glutamátu, reaktivita lymfocytů a úmrtí u pacientů s bronchiálním karcinomem". Journal of Cancer Research and Clinical Oncology. 115 (6): 571–574. doi:10.1007 / BF00391360. PMID 2558118. S2CID 23057794.
- ^ Grimm, H; Tibell A; Norrlind B; Blecher C; Wilker S; Schwemmle K (1994). „Imunoregulace rodičovskými lipidy: dopad poměru n-3 k n-6 mastným kyselinám“. Journal of Parenteral and Enteral Nutrition. 18 (5): 417–421. doi:10.1177/0148607194018005417. PMID 7815672.
- ^ Jiang, WG; Bryce RP; Hoorobin DF (1998). „Esenciální mastné kyseliny: molekulární a buněčné základy jejich protirakovinného působení a klinické důsledky“. Kritické recenze v onkologii / hematologii. 27 (3): 179–209. doi:10.1016 / S1040-8428 (98) 00003-1. PMID 9649932.
