GC zkosení - GC skew

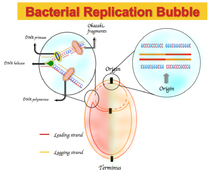
GC zkosení je, když nukleotidy guanin a cytosin jsou nadměrně nebo nedostatečně hojní v konkrétní oblasti DNA nebo RNA. V rovnovážných podmínkách (bez mutační nebo selektivní tlak a s nukleotidy náhodně distribuovanými uvnitř genom ) je stejná frekvence čtyř bází DNA (adenin, guanin, tymin, a cytosin ) na obou jednotlivé prameny molekuly DNA.[1] Ve většině případů však bakterie (např. E-coli ) a nějaký archaea (např. Sulfolobus solfataricus ), nukleotidové kompozice jsou mezi přední vlákno a zaostávající vlákno: hlavní řetězec obsahuje více guaninu (G) a thyminu (T), zatímco zaostávající řetězec obsahuje více adeninu (A) a cytosinu (C).[1] Tento jev se označuje jako GC a AT šikmo. Je matematicky znázorněna takto:[2]
GC zkosení = (G - C) / (G + C)
Zkosení AT = (A - T) / (A + T)
Asymetrické složení nukleotidů
Erwin Chargaff Práce v roce 1950 prokázala, že v DNA byly báze guaninu a cytosinu nalezeny ve stejném množství a báze adeninu a thyminu ve stejném množství. Mezi množstvím jednoho však nebyla rovnost pár proti druhému.[3] Chargaffův nález je označován jako Chargaffovo pravidlo nebo paritní pravidlo 1.[3] O tři roky později využili Watson a Crick tuto skutečnost při odvozování struktury DNA, své model dvojité šroubovice.
Přirozeným výsledkem pravidla parity 1, ve stavu rovnováhy, ve kterém nedochází k žádným zkreslením mutace a / nebo selekce v kterémkoli ze dvou řetězců DNA, je, že když existuje stejná míra substituce, komplementární nukleotidy na každém řetězci mají stejné množství dané základny a jejího doplňku.[4] Jinými slovy, v každém řetězci DNA se frekvence výskytu T rovná A a frekvence výskytu G se rovná C, protože míra substituce je pravděpodobně stejná. Tento jev se označuje jako paritní pravidlo 2. Druhé paritní pravidlo tedy existuje pouze v případě, že neexistuje mutace nebo substituce.
Jakákoli odchylka od pravidla parity 2 bude mít za následek asymetrické základní složení, které rozlišuje přední řetězec - tj. Řetězec DNA, který se replikuje v dopředném směru - od zaostávajícího řetězce. Tato asymetrie se označuje jako GC nebo AT zkosení.[1]
V některých bakteriálních genomech dochází k obohacení guaninu nad cytosin a tyminu nad adenin na hlavním řetězci a naopak pro zaostávající řetězec. Spektra spektra zkreslení nukleotidů se pohybují od -1, což odpovídá G = 0 nebo A = 0, do +1, což odpovídá T = 0 nebo C = 0.[1] Proto pozitivní GC zkosení představuje bohatství G nad C a negativní GC zkosení představuje bohatství C nad G. Výsledkem je, že člověk očekává pozitivní GC zkosení a negativní AT zkosení v předním řetězci a negativní GC zkosení a pozitivní zkreslení AT v zaostávajícím řetězci.[5] Znaménko změn GC nebo AT na hranici těchto dvou replichores, které odpovídají počátku nebo konci replikace DNA.[1][4][5] Původně byla tato asymetrická nukleotidová kompozice vysvětlena jako odlišný mechanismus používaný v replikace DNA mezi předním a zaostávajícím vláknem. Replikace DNA je polokonzervativní a samotný asymetrický proces.[6] Tato asymetrie je způsobena vytvořením replikační vidlice a jejím rozdělením na rodící se přední a zaostávající prameny. Vedoucí řetězec je syntetizován kontinuálně a v sousedství vedoucího řetězce; zaostávající řetězec je replikován prostřednictvím krátkých fragmentů polynukleotidu (Okazaki fragmenty ) ve směru 5 'až 3'.[6]
Výpočty a grafy zkosení GC
Existují tři hlavní přístupy k výpočtu a grafické demonstraci zkosení GC a jeho vlastností.
GC asymetrie
Prvním přístupem je asymetrie GC a AT.[1] Jean R. Lobry jako první ohlásil v roce 1996,[7] přítomnost kompoziční asymetrie v genomech tří bakterií: E-coli, Bacillus subtilis, a Haemophilus influenzae. Původní vzorce v té době nebyly nazývány zkosením, ale spíše odchylkou od [A] = [T] nebo [C] = [G]:
odchylka od [A] = [T] jako (A - T) / (A + T);
odchylka od [C] = [G] jako (C - G) / (C + G);
kde A, T, G a C představují frekvenci výskytu ekvivalentní báze v konkrétní sekvenci v definované délce. K výpočtu odchylky od C přes genom se používá posuvná strategie okna. V těchto grafech pozitivní odchylka od C odpovídá zaostávajícímu řetězci a negativní odchylka od C odpovídá vedoucímu řetězci.[8] Místo, kde se přepíná značka odchylky, navíc odpovídá původu nebo terminálu. Osa x představuje umístění chromozomů vynesená od 5 'do 3' a osa y představuje hodnotu odchylky. Hlavní slabinou této metody je její vlastnost závislá na velikosti okna. Proto výběr adekvátní velikosti okna výrazně ovlivňuje výsledek grafu. Jiné techniky by měly být kombinovány s odchylkou, aby bylo možné s větší přesností identifikovat a lokalizovat původ replikace DNA.
CGC zkosení
Druhý přístup se označuje jako kumulativní zkosení GC (CGC zkosení).[2] Tato metoda stále používá strategii posuvného okna, ale využívá součet sousedních oken od libovolného začátku. V tomto schématu je celý genom obvykle vynesen na 5 'až 3' pomocí libovolného začátku a libovolného řetězce. V kumulativním grafu zkosení GC vrcholy odpovídají spínacím bodům (konec nebo počátek).
Na rozdíl od Lobryho dřívějšího článku, nedávná implementace GC skew převrátí původní definici a předefinuje ji tak, aby byla:
GC zkosení = (G - C) / (G + C).
S převrácenou definicí zkosení GC odpovídá maximální hodnota kumulativního zkosení terminálu a minimální hodnota odpovídá počátku replikace.
Křivka Z.
Konečným přístupem je Křivka Z..[9] Na rozdíl od předchozích metod tato metoda nepoužívá strategii posuvného okna a je považována za lepší při hledání původu replikace.[9] V této metodě je každá základna kumulativní frekvence vzhledem k základně na začátku sekvence se zkoumá. Křivka Z používá trojrozměrné znázornění s následujícími parametry:
Kde , představuje přebytek purinu nad pyrimidinem, označuje přebytek keto nad amino, a ukazuje vztah mezi slabým a silným Vodíkové vazby. a komponenty mohou samy detekovat počátek replikace a asymetrické složení řetězců. Pro predikci počátku replikace a terminálu by se měla použít kombinace těchto metod, aby se vyrovnala jejich slabost.
Mechanismus
Ve vědecké komunitě chybí shoda ohledně mechanismu, který je základem zkreslení ve složení nukleotidů v každém řetězci DNA. Existují dvě hlavní myšlenkové směry, které vysvětlují mechanismus za složením specifického nukleotidového složení v bakteriích.[4]
První popisuje zkreslení a asymetrický mutační tlak na každém řetězci DNA během replikace a transkripce.[4][10] Vzhledem k asymetrické povaze replikačního procesu, nerovnoměrné mutační frekvenci a Oprava DNA efektivita během procesu replikace může přinést více mutace v jednom řetězci ve srovnání s druhým.[5] Kromě toho se doba použitá pro replikaci mezi dvěma řetězci liší a může vést k asymetrickému mutačnímu tlaku mezi vedoucím a zaostávajícím řetězcem.[11] Kromě mutací během replikace DNA mohou transkripční mutace vytvářet zkreslení nukleotidové kompozice specifické pro vlákno.[5] Odminování Cytosin a nakonec mutace cytosinu na thymin v jednom řetězci DNA může zvýšit relativní počet guaninu a thyminu na cytosin a adenin.[5] U většiny bakterií je většina genů kódována v předním řetězci.[4] Například hlavní oblast v Bacil subtilis kóduje 75% genů.[5] Kromě toho byl zaznamenán přebytek deaminace a přeměny cytosinu na thymin v kódujícím řetězci ve srovnání s nekódujícím řetězcem.[4][5][12] Jedním z možných vysvětlení je, že nepřepisovaný řetězec (kódovací vlákno ) je během procesu transkripce jednořetězcová; proto je ve srovnání s přepisovaným vláknem citlivější na deaminaci (nekódující vlákno ).[5][13] Dalším vysvětlením je, že deaminační opravná aktivita během transkripce nenastává na kódujícím řetězci.[5] Pouze transkribované vlákno těží z těchto opravných událostí deaminace.
Druhá myšlenková škola popisuje mechanismus vychýlení GC a AT jako výsledek rozdílu v selektivní tlak mezi předními a zaostávajícími prameny.[4][5][13] Vyšetření prokaryotického genomu ukazuje preference ve třetí pozici kodonu pro G nad C a T nad A.[5] Tato diskriminace vytváří asymetrické nukleotidové složení, pokud je kódující řetězec nerovnoměrně rozdělen mezi přední a zaostávající řetězce, jako je tomu v případě bakterií. Kromě toho vysoce transkribované geny, jako např ribozomální proteiny Bylo prokázáno, že se nacházejí většinou na hlavním řetězci bakterií.[5] Předpětí ve výběru kodonu třetí polohy G nad C proto může vést ke zkosení GC. Některé signální sekvence jsou navíc bohaté na guanin a thymin, jako například chi sekvence a tyto sekvence mohou mít vyšší frekvenci výskytu v jednom řetězci ve srovnání s druhým.[4][5]
Mutační i selektivní tlak může nezávisle zavést asymetrii do řetězců DNA. Kombinace a kumulativní účinek obou mechanismů je však nejpravděpodobnějším vysvětlením zkosení GC a AT.[4][13]
Použití
Ukázalo se, že GC zkosení je užitečné jako indikátor řetězce DNA vedoucího, zaostávajícího řetězce, počátku replikace a terminálu replikace.[1][4][5] Většina bakterií a archea obsahuje pouze jeden počátek replikace DNA.[1] Zkosení GC je pozitivní a negativní v předním řetězci a v zaostávajícím řetězci; proto se očekává, že dojde ke změně znaménka zkosení GC právě v místě počátku a konce replikace DNA.[4] GC zkosení lze také použít ke studiu zkreslení pramenů a mechanismů s nimi souvisejících výpočtem přebytku jedné základny nad její komplementární základnou v různých prostředích.[4][5][13] Metody jako GC zkosení, CGC zkosení a Z křivka jsou nástroje, které mohou poskytnout příležitost k lepšímu zkoumání mechanismu replikace DNA v různých organismech.
Reference
- ^ A b C d E F G h Lobry, J. R. Asymetrické substituční vzorce ve dvou řetězcích DNA bakterií. Molekulární biologie a evoluce 13, 660-665 (1996).
- ^ A b Grigoriev, A. Analýza genomů pomocí kumulativních šikmých diagramů. Nucleic Acids Research 26, 2286-2290 (1998).
- ^ A b Chargaff, E. Chemická specificita nukleových kyselin a mechanismus jejich enzymatické degradace. Experientia 6, 201-209 (1950).
- ^ A b C d E F G h i j k l Necsulea, A. & Lobry, J. R. Nová metoda pro hodnocení vlivu replikace na asymetrii složení DNA báze. Molekulární biologie a evoluce 24, 2169-2179, doi: 10,1093 / molbev / msm148 (2007).
- ^ A b C d E F G h i j k l m n Ó Tillier, E. R. & Collins, R. A. Příspěvky orientace replikace, směru genů a signálních sekvencí k asymetrii základního složení v bakteriálních genomech. Journal of molekulární evoluce 50, 249-257 (2000).
- ^ A b Rocha, E. P. Organizace bakteriálních genomů související s replikací. Microbiology 150, 1609-1627, doi: 10,1099 / mic.0.26974-0 (2004).
- ^ Lobry, J. R. (květen 1996). „Asymetrické substituční vzorce ve dvou řetězcích DNA bakterií“. Molekulární biologie a evoluce. 13 (5): 660–665. doi:10.1093 / oxfordjournals.molbev.a025626. ISSN 0737-4038. PMID 8676740.
- ^ „Vysvětlení článku Lobryho z roku 1996“
- ^ A b Zhang, R. & Zhang, C. T. Mnohonásobné počátky replikace archaeonu druhu Halobacterium NRC-1. Biochemical and biophysical research communications 302, 728-734 (2003).
- ^ Lobry, J. R. & Sueoka, N. Asymetrické tlaky směrové mutace v bakteriích. Genome biology 3, RESEARCH0058 (2002).
- ^ Eppinger, M., Baar, C., Raddatz, G., Huson, D. H. & Schuster, S. C. Srovnávací analýza čtyř Campylobacterales. Recenze přírody. Microbiology 2, 872-885, doi: 10,1038 / nrmicro1024 (2004).
- ^ Marin, A. & Xia, X. GC vychýlení v genech kódujících bílkoviny mezi předními a zaostávajícími řetězci v bakteriálních genomech: nové substituční modely zahrnující zkreslení řetězců. Journal of teoretické biologie 253, 508-513, doi: 10,1016 / j.jtbi.2008.04.004 (2008).
- ^ A b C d Charneski C.A., Honti F., Bryant J.M., Hurst L.D., Feil E.J. Atypické zkreslení AT v genech Firmicute je výsledkem výběru a nikoli mutace. PLoS Genetics 7 (9): e1002283 (2011).
- Mewes, H. W. a kol. MIPS: analýza a anotace proteinů z celých genomů v roce 2005. Nucleic Acids Res 34, D169-172, doi: 10,1093 / nar / gkj148 (2006).









