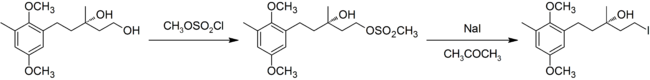Finkelsteinova reakce - Finkelstein reaction
| Finkelsteinova reakce | |
|---|---|
| Pojmenoval podle | Hans Finkelstein |
| Typ reakce | Substituční reakce |
| Identifikátory | |
| Portál organické chemie | finkelsteinova reakce |
| RSC ontologické ID | RXNO: 0000155 |
The Finkelsteinova reakce pojmenoval podle německého chemika Hans Finkelstein,[1] je SN2 reakce (Substitution Nucleophilic Bimolecular reaction), která zahrnuje výměnu jedné halogen atom pro jiného. Je to rovnovážná reakce, ale reakce může být dokončena využitím diferenciální rozpustnost halogenidových solí nebo použitím velkého přebytku halogenidové soli.[2]
- R – X + X ′− ⇌ R – X ′ + X−
Metoda
Klasická Finkelsteinova reakce znamená konverzi alkylchlorid nebo alkylbromid do alkyljodid ošetřením roztokem jodid sodný v aceton. Jodid sodný je přitom rozpustný v acetonu chlorid sodný a bromid sodný nejsou.[3] Reakce směřuje k produktům pomocí hromadná akce v důsledku srážení špatně rozpustného NaCl nebo NaBr. Příklad zahrnuje konverzi ethylesteru 5-bromukyselina valerová k jodidu:[4]
- EtO2C (CH2)4Br + NaI → EtO2C (CH2)4I + NaBr
Fluorid draselný se používá pro převod chlorované uhlovodíky do fluorované uhlovodíky.[5] Takové reakce obvykle používají polární rozpouštědla, jako je dimethylformamid, ethylenglykol, a dimethylsulfoxid.[6]
Použijte pro analýzu
Alkylhalogenidy se velmi liší v lehkosti, s jakou procházejí Finkelsteinovou reakcí. Reakce funguje dobře pro primární (kromě neopentyl ) halogenidy a výjimečně dobře pro allyl, benzyl a a-karbonylhalogenidy. Sekundární halogenidy jsou mnohem méně reaktivní. Vinyl, aryl a terciární alkylhalogenidy jsou nereaktivní; ve výsledku lze reakci NaI v acetonu použít jako kvalitativní test k určení, do které ze shora uvedených tříd patří neznámý alkylhalogenid, s výjimkou alkyljodidů, protože po substituci poskytují stejný produkt. Níže jsou uvedeny některé relativní rychlosti reakce (NaI v acetonu při 60 ° C):[7][8]
| Me – Cl | Bu – Cl | i-Pr – Cl | t-BUCH2–Cl | CH2= CH – CH2–Cl | PhCH2–Cl | EtOC (O) CH2–Cl | MeC (O) CH2–Cl |
|---|---|---|---|---|---|---|---|
| 179 | 1 | 0.0146 | 0.00003 | 64 | 179 | 1600 | 33000 |
V moderním použití byla definice reakce rozšířena o převod na alkoholy na alkylhalogenidy nejprve převedením alkoholu na a sulfonát ester (tosyláty nebo mesyláty se obvykle používají), a poté provést substituci. Níže uvedený příklad je ze syntézy kyselina chrysochlamová.[9]
Aromatická Finkelsteinova reakce
Aromatické chloridy a bromidy nejsou snadno jodidem substituovány, i když se mohou vhodně katalyzovat, mohou nastat. Takzvaná „aromatická Finkelsteinova reakce“ je katalyzována jodid měďný v kombinaci s diaminovými ligandy.[10] Bromid nikelnatý a tri-n-butylfosfin bylo také zjištěno, že jsou vhodnými katalyzátory.[11]
Viz také
- Proces Halex, také metathéza soli, ale pro konverzi arylchloridů na arylfluoridy
Reference
- ^ Finkelstein, Hans (1910). „Darstellung organischer Jodide aus den entsprechenden Bromiden und Chloriden“. Ber. Dtsch. Chem. Ges. (v němčině). 43 (2): 1528–1532. doi:10,1002 / cber.19100430257.
- ^ Smith, Michael B .; March, Jerry (2007), Pokročilá organická chemie: reakce, mechanismy a struktura (6. vydání), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Ervithayasuporn, V. (2013). „Syntéza silsesquioxanů s výměnou halogenů v jedné nádobě: oktakis (3-brompropyl) oktasilsesquioxan a octakis (3-jodpropyl) oktasilsesquioxan“. Dalton Trans. 42 (37): 13747–13753. doi:10.1039 / C3DT51373D. PMID 23907310.
- ^ B. H. Lipshutz, M. R. Wood a R. Tirado (1999). "Konjugát katalyzovaný mědí Přidání funkcionalizovaných organozinkových reagencií k a, β-nenasyceným ketonům: Ethyl 5- (3-oxocyklohexyl) pentanoát". Org. Synth. 76: 252. doi:10.15227 / orgsyn.076.0252.CS1 maint: používá parametr autoři (odkaz)
- ^ Vogel, A. I .; Leicester, J .; Macey, W. A. T. (1956). „n-hexylfluorid“. Organické syntézy. 36: 40. doi:10.15227 / orgsyn.036.0040.
- ^ Han, Q .; Li, H-Y. „Fluorid draselný“ v Encyclopedia of Reagents for Organic Synthesis, 2001 John Wiley & Sons, New York. doi:10.1002 / 047084289X.rp214
- ^ Streitwieser, A. (1956). "Solvolytické posunovací reakce v atomech nasyceného uhlíku". Chem. Rev. 56 (4): 571–752. doi:10.1021 / cr50010a001.
- ^ Bordwell, F. G .; Brannen, W. T. (1964). „Vliv karbonylu a příbuzných skupin na reaktivitu halogenidů v S.N2 reakce “. J. Am. Chem. Soc. 86 (21): 4645–4650. doi:10.1021 / ja01075a025.
- ^ Maloney, D. J .; Hecht, S. M. (2005). „Stereo řízená syntéza δ-trans- Kyselina tokotrienoloová “. Org. Lett. 7 (19): 4297–300. doi:10.1021 / ol051849t. PMID 16146411.
- ^ Klapars, A .; Buchwald, S.L. (2002). „Výměna halogenů katalyzovaných mědí v arylhalogenidech: aromatická Finkelsteinova reakce“. J. Am. Chem. Soc. 124 (50): 14844–14845. doi:10.1021 / ja028865v. PMID 12475315.
- ^ Cant, Alastair A .; Bhalla, Rajiv; Pimlott, Sally L .; Sutherland, Andrew (2012). "Niklem katalyzovaná aromatická Finkelsteinova reakce aryl a heteroarylbromidů". Chem. Commun. 48 (33): 3993–5. doi:10.1039 / c2cc30956d. PMID 22422214.