Dimethylglyoxim - Dimethylglyoxime
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC N,N '-Dihydroxy-2,3-butandiimin | |
Ostatní jména
| |
| Identifikátory | |
3D model (JSmol ) | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.002.201 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4H8N2Ó2 | |
| Molární hmotnost | 116.120 g · mol−1 |
| Vzhled | Bílý / téměř bílý prášek |
| Hustota | 1,37 g / cm3 |
| Bod tání | 240 až 241 ° C (464 až 466 ° F; 513 až 514 K) |
| Bod varu | rozkládá se |
| nízký | |
| Struktura | |
| 0 | |
| Nebezpečí | |
| Hlavní nebezpečí | Jedovatý, dráždivý pro kůži / oči |
| Bezpečnostní list | Externí bezpečnostní list |
| Piktogramy GHS |   |
| Signální slovo GHS | Nebezpečí |
| H228, H301 | |
| P210, P240, P241, P264, P270, P280, P301 + 310, P321, P330, P370 + 378, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
Související sloučeniny | Hydroxylamin salicylaldoxim |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Dimethylglyoxim je chemická sloučenina popsáno vzorcem CH3C (NOH) C (NOH) CH3. Jeho zkratka je dmgH2 pro neutrální formu a dmgH pro aniontovou formu, kde H znamená vodík. Tato bezbarvá pevná látka je dioxim derivát diketon butan-2,3-dionu (také známý jako diacetyl ). DmgH2 se používá při analýze palladium nebo nikl. Své koordinační komplexy jsou teoreticky zajímavé jako modely pro enzymy a jako katalyzátory. Mnoho příbuzných ligandů může být připraveno z jiných diketonů, např. benzil.
Příprava
Dimethylglyoxim lze připravit z butanon nejprve reakcí s ethylnitrit dát biacetylmonoxim. Druhý oxim je instalován pomocí sodíku hydroxylamin monosulfonát:[1]

Komplexy
Dimethylglyoxim tvoří komplexy s kovy včetně Nikl,[2] Palladium, a Kobalt.[3] Tyto komplexy se používají k oddělení těchto komplexů od roztoků solí kovů. Používá se také v rafinace drahých kovů vysrážet palladium z řešení chlorid palladnatý.
- Dimethylglyoxime komplexy
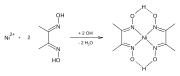
Reakce tvorby Ni-dmg

Vzorek Ni (dmgH)2

Struktura chlor (pyridinu) kobajloximu
Reference
- ^ Semon, W. L .; Damerell, V. R. (1930). "Dimetylglyoxim". Organické syntézy. 10: 22. doi:10.15227 / orgsyn.010.0022.
- ^ Lev Tschugaeff (1905). „Über ein neues, empfindliches Reagens auf Nickel“. Berichte der Deutschen Chemischen Gesellschaft. 38 (3): 2520–2522. doi:10,1002 / cber.19050380317.
- ^ Girolami, G. S .; Rauchfuss, T.B .; Angelici, R. J. (1999). Syntéza a technika v anorganické chemii: Laboratorní příručka (3. vyd.). 213–215.




