Dekarbonylace - Decarbonylation
Dekarbonylace je typ organické reakce, která zahrnuje ztrátu CO. Je to často nežádoucí reakce, protože představuje degradaci. V chemii kovové karbonyly, dekarbonylace popisuje proces substituce, kdy je CO ligand nahrazen jiným ligandem.
Organická chemie
Při absenci kovových katalyzátorů je v organické chemii zřídka pozorována dekarbonylace (vs. dekarboxylace). Jedinou výjimkou je dekarbonylace kyselina mravenčí:
- HCO2H → CO + H2Ó
Reakce je vyvolána kyselina sírová, který funguje jako katalyzátor i dehydratační prostředek. Prostřednictvím této reakce se kyselina mravenčí příležitostně používá jako zdroj CO v laboratoři místo lahví s tímto toxickým plynem.[1] Při silném zahřívání může kyselina mravenčí a některé její deriváty podléhat dekarbonylaci, a to i bez přidání katalyzátoru. Například, dimethylformamid pomalu se rozkládá za vzniku dimethylaminu a oxidu uhelnatého při zahřátí na teplotu varu (154 ° C). Některé deriváty kyseliny mravenčí, jako formylchlorid, podstoupit spontánní dekarbonylaci při pokojové teplotě (nebo nižší).
Reakce zahrnují oxalylchlorid (COCl)2 (např. hydrolýza, reakce s karboxylovými kyselinami, Swernova oxidace atd.) často uvolňují jak oxid uhličitý, tak oxid uhelnatý prostřednictvím procesu fragmentace.
α-hydroxykyseliny, např. (kyselina mléčná a kyselina glykolová ) podstoupit dekarbonylaci při zpracování s katalytickou koncentrovanou kyselinou sírovou, pomocí následujícího mechanismu:[2]
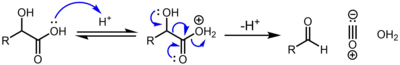
Silakarboxylové kyseliny (R.3SiCOOH) podléhají dekarbonylaci při zahřívání nebo zpracování bází a byly zkoumány jako molekuly generující oxid uhelnatý.[3][4]
Aldehydová dekarbonylace
Běžná transformace zahrnuje přeměnu aldehydy na alkany.[5]
- RCHO → RH + CO
Dekarbonylace může být katalyzovaný rozpustnými kovovými komplexy.[6][5] Tyto reakce probíhají prostřednictvím intermediátu kovu acyl hydridy. Příkladem toho je Tsuji – Wilkinsonova dekarbonylační reakce použitím Wilkinsonův katalyzátor. (Přísně vzato, nekatalytická verze této reakce vede spíše k tvorbě rhodium karbonylového komplexu než volného oxidu uhelnatého.) Tato reakce se obecně provádí v malém měřítku v průběhu komplexní syntézy komplexního přírodního produktu, protože i když tato reakce je velmi účinný při mírně zvýšených teplotách (např. 80 ° C), když se používá stechiometrický rhodium, vyžaduje výměna katalyzátoru vytlačováním CO disociaci velmi stabilního rhodium karbonylového komplexu a jsou nutné teploty přesahující 200 ° C. Tato konverze má hodnotu v organická syntéza, kde je dekarbonylace jinak vzácnou reakcí.

Dekarbonylace jsou zajímavé při přeměně cukrů.[7]Ketony a další funkční skupiny obsahující karbonyl jsou odolnější vůči dekarbonylaci než aldehydy.
Pericyklické reakce
Nějaký cyklické molekuly obsahující a keton podstoupit a cheletropická extruzní reakce, takže nový uhlík – uhlík π vazby na zbývající struktuře. Tato reakce může být spontánní, jako při syntéze hexafenylbenzen. Cyklopropenony a cyklobutenediones lze převést na alkyny eliminací jedné, respektive dvou molekul CO.[8]
Biochemie
Oxid uhelnatý se uvolňuje při degradaci (katabolismu) hemu působením O2, NADPH a enzym hem oxygenáza:[9]
- Heme b + 3 O2 + 31⁄2NADPH + 31⁄2H+ → biliverdin + Fe2+ + CO + 31⁄2NADP+ + 3H2Ó
Anorganická a organokovová syntéza
Mnoho karbonylů kovů se připravuje dekarbonylačními reakcemi. CO ligand dovnitř Vaskův komplex vzniká dekarbonylací DMF:
- IrCl3(H2Ó)3 + 3 P (C.6H5)3 + HCON (CH3)2 + C.6H5NH2 → IrCl (CO) [P (C.6H5)3]2 + [(CH3)2NH2] Cl + OP (C.6H5)3 + [C.6H5NH3] Cl + 2 H2Ó
Konverze Fe (CO)5 a Mo (CO)6 jejich mnoho derivátů často zahrnuje dekarbonylaci. Zde dekarbonylace doprovází přípravu Cyklopentadienyliron dikarbonyl dimer:
- 2 Fe (CO)5 + C.10H12 → (η5-C5H5)2Fe2(CO)4 + 6 CO + H2
Dekarbonylaci lze vyvolat fotochemicky i za použití činidel, jako jsou trimethylamin N-kysličník:
- Mě3NO + L + Fe (CO)5 → Já3N + CO2 + LFe (CO)4
Reference
- ^ Koch, H .; Haaf, W. (1973). "Kyselina 1-adamantankarboxylová". Organické syntézy.; Kolektivní objem, 5, str. 20
- ^ Norman, Richard Oswald Chandler; Coxon, James Morriss (1993). Principy organické syntézy (3. vyd.). London: Blackie Academic & Professional. p. 709. ISBN 0751401269. OCLC 27813843.
- ^ Brook, A. G .; Gilman, Henry (duben 1955). „Zásadně katalyzované eliminační reakce kyseliny trifenylsilankarboxylové a jejích derivátů“. Journal of the American Chemical Society. 77 (8): 2322–2325. doi:10.1021 / ja01613a088. ISSN 0002-7863.
- ^ Friis, Stig D .; Taaning, Rolf H .; Lindhardt, Anders T .; Skrydstrup, Troels (16. 11. 2011). „Silakarboxylové kyseliny jako účinné molekuly uvolňující oxid uhelnatý: syntéza a aplikace v karbonylačních reakcích katalyzovaných palladiem“. Journal of the American Chemical Society. 133 (45): 18114–18117. doi:10.1021 / ja208652n. ISSN 0002-7863. PMID 22014278.
- ^ A b Kreis, M .; Palmelund, A .; Bunch, L .; Madsen, R., "A General and Convenient Method for the Rhodium-Catalyzed Decarbonylation of Aldehydes", Advanced Synthesis & Catalysis 2006, 348, 2148-2154. doi:10.1002 / adsc.200600228
- ^ Hartwig, J. F. Organotransition Metal Chemistry, od Bonding to Catalysis; University Science Books: New York, 2010.
- ^ Geilen, F. M. A .; vom Stein, T .; Engendahl, B .; Winterle, S .; Liauw, M. A .; Klankermayer, J .; Leitner, W., „Vysoce selektivní dekarbonylace 5- (hydroxymethyl) furfuralu v přítomnosti stlačeného oxidu uhličitého“, Angew. Chem. Int. Vyd. 2011, 50, 6831-6834. doi:10,1002 / anie.201007582
- ^ Rubin, Yves; Knobler, Carolyn B .; Diederich, Francois (1990). „Předchůdci cyklo [n] uhlíky: od 3,4-dialkynyl-3-cyklobuten-1,2-dionů a 3,4-dialkynyl-3-cyklobuten-1,2-diolů po cyklobutenodehydroannuleny a vyšší oxidy uhlíku ". J. Am. Chem. Soc. 112: 1607–1617. doi:10.1021 / ja00160a047.
- ^ Ryter, S. W .; Tyrrell, R. M., „The Heme Synthesis and Degradation Pathways: Role in Oxidant Sensitive: Heme Oxygenase has both Pro- and Antioxidant Properties“, Free Radical Biology and Medicine 2000, svazek 28, strany 289-309. doi:10.1016 / S0891-5849 (99) 00223-3

