Cheletropická reakce - Cheletropic reaction

Cheletropické reakce také známý jako chelotropní reakce[1] jsou typem pericyklická reakce. Pericyklická reakce je reakce, která zahrnuje přechodový stav s cyklickým polem atomů a přidruženým cyklickým polem interagujících orbitalů. V tomto cyklickém poli dochází k reorganizaci vazeb σ a π.[2]
Cheletropické reakce jsou konkrétně podtřídou cykloadic. Klíčovým rozlišovacím znakem cheletropických reakcí je, že na jednom z činidel se vytvářejí obě nové vazby na stejný atom.[3] Několik příkladů je zobrazeno vpravo. V prvním případě je jediným atomem karbonylový uhlík, který končí v oxidu uhelnatém. Konečným výsledkem je vytvoření dvou nových vazeb k jednomu atomu. První dva příklady jsou známé jako cheletropické vytlačování, protože se při reakci uvolňuje malá stabilní molekula. Hnací silou těchto reakcí je často entropická výhoda plynného vývoje (např. CO nebo N2).[2]
Teoretická analýza
V pericyklickém přechodovém stavu malá molekula daruje dva elektrony do kruhu. Reakční proces lze ukázat pomocí dvou různých geometrií, malá molekula může přistupovat lineárně nebo nelineárně. V lineárním přístupu jsou elektrony na oběžné dráze malé molekuly namířeny přímo na π-systém. V nelineárním přístupu se orbita přibližuje pod šikmým úhlem. Schopnost systému π rotovat, jak se blíží malá molekula, je zásadní pro vytváření nových vazeb. Směr otáčení se bude lišit v závislosti na tom, kolik π-elektronů je v systému. Níže je uveden diagram dvouelektronového fragmentu blížícího se čtyřelektronovému π-systému pomocí hraničních molekulárních orbitalů. Rotace bude disrotační, pokud se malá molekula přiblíží lineárně, a rotační, pokud se molekula přiblíží nelineárně. Disrotatory a conrotatory jsou sofistikované výrazy vyjadřující, jak se vazby v π-systému otáčejí. Disrotatory znamená opačné směry, zatímco conrotatory znamená stejný směr. To je také znázorněno na obrázku níže.
Podle Hückelova pravidla lze zjistit, zda je π-systém aromatický nebo antiaromatický. Pokud jsou aromatické, lineární přístupy používají disrotační pohyb, zatímco nelineární přístupy používají konrotační pohyb. Opakem je antiaromatický systém. Lineární přiblížení bude mít pohyb v pohybu, zatímco nelineární přiblížení bude mít pohyb v pohybu.[2]
Cheletropické reakce zahrnující SO2
Termodynamika
V roce 1995 Suarez a Sordo ukázali, že při reakci reagoval s oxidem siřičitým butadien a isopren dává dva různé produkty v závislosti na mechanismu. To bylo ukázáno experimentálně a za použití ab initio výpočty. Kinetický i termodynamický produkt jsou možné, ale termodynamický produkt je příznivější. Kinetický produkt vzniká z a Diels-Alderova reakce, zatímco cheletropická reakce vede k termodynamicky stabilnějšímu produktu. Cheletropická dráha je upřednostňována, protože vede ke stabilnějšímu pětičlennému kruhovému aduktu. Níže uvedené schéma ukazuje rozdíl mezi těmito dvěma produkty, cesta vpravo ukazuje stabilnější termodynamický produkt, zatímco cesta vlevo ukazuje kinetický produkt.[4]
Kinetika
Cheletropické reakce 1,3-dienů s oxid siřičitý byly rozsáhle zkoumány z hlediska kinetiky (obecná reakce viz výše).
V prvním kvantitativním měření kinetických parametrů této reakce měřila studie Isaacse a Laily z roku 1976 rychlosti přidávání oxidu siřičitého k derivátům butadienu. Míry přidání byly sledovány v benzenu při 30 ° C s počátečním dvacetinásobným přebytkem oxidu siřičitého, což umožnilo aproximaci pseudo prvního řádu. Zmizení SO2 bylo sledováno spektrofotometricky při 320 nm. Reakce ukázala pseudo kinetiku prvního řádu. Některé zajímavé výsledky byly, že skupiny odběrající elektrony na dienu snížily rychlost reakce. Reakční rychlost byla také značně ovlivněna stérickými účinky 2-substituentů, přičemž objemnější skupiny zvyšovaly rychlost reakce. Autoři to připisují tendenci objemných skupin upřednostňovat cisoidní konformaci dienu, která je nezbytná pro reakci (viz tabulka níže). Kromě toho byly rychlosti u čtyř teplot měřeny u sedmi dienů, což umožňovalo výpočet entalpie aktivace (ΔH‡) a entropie aktivace (ΔS‡) pro tyto reakce prostřednictvím Arrheniova rovnice.[5]
| -Butadien | 104 k / min−1 (30 ° C) (± 1-2%) absolutní | 104 k / min−1 (30 ° C) (± 1-2%) relativní | ΔH‡ / kcal mol−1 | ΔS‡ / kal mol−1 K.−1 |
|---|---|---|---|---|
| 2-methyl | 1.83 | 1.00 | 14.9 | -15 |
| 2-ethyl | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropyl | 13.0 | 7.38 | 12.5 | -17 |
| 2-terc-butyl | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentyl | 17.2 | 9.4 | 11.6 | -18 |
| 2-chlor | 0.24 | 0.13 | N / A | N / A |
| 2-bromethyl | 0.72 | 0.39 | N / A | N / A |
| 2-p-tolyl | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenyl | 17.3 | 9.45 | N / A | N / A |
| 2- (p-bromfenyl) | 9.07 | 4.96 | N / A | N / A |
| 2,3-dimethyl | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-methyl | 0.18 | 0.10 | N / A | N / A |
| trans-1-methyl | 0.69 | 0.38 | N / A | N / A |
| 1,2-dimethylencyklohexan | 24.7 | 13.5 | 11.4 | -16 |
| 2-methyl-1,1,4,4-d4 | 1.96 | N / A | N / A | N / A |
Nedávno studie Monnat, Vogel a Sordo z roku 2002 měřila kinetiku přidávání oxidu siřičitého k 1,2-dimethylidenecykloalkanům. Zajímavým bodem prezentovaným v tomto článku je, že reakce 1,2-dimethylidenecyklohexanu s oxidem siřičitým může poskytnout dva různé produkty v závislosti na reakčních podmínkách. Reakce produkuje odpovídající sulfin prostřednictvím hetero-Diels-Alderovy reakce za kinetické kontroly (≤ -60 ° C), ale za termodynamické kontroly (≥ -40 ° C), reakce produkuje odpovídající sulfolen prostřednictvím cheletropické reakce. Aktivační entalpie pro reakci hetero-Diels-Alder je o 8 kJ / mol menší než u odpovídající cheletropické reakce. Sulfolen je asi o 40 kJ / mol stabilnější než isometrický sulfin v CH2Cl2/TAK2 řešení.[6]
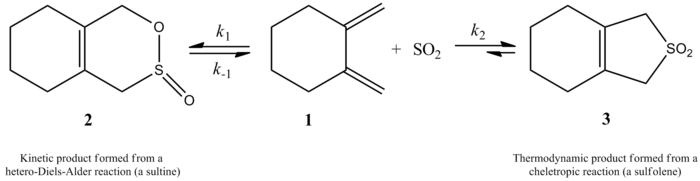
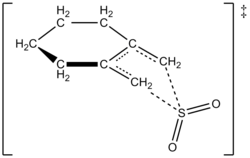
Autoři byli schopni experimentálně stanovit zákon rychlosti při 261,2 K pro reakci 1,2-dimethylidenecyklohexanu s oxidem siřičitým za vzniku odpovídajícího sulfolenu. Reakce byla prvního řádu v 1,2-dimethylidenecyklohexanu, ale druhého řádu v oxidu siřičitém (viz níže). To potvrdilo předpověď na vysoké úrovni ab initio kvantové výpočty. Za použití výpočetních metod autoři navrhli přechodovou strukturu pro cheletropickou reakci 1,2-dimethylidenecyklohexanu s oxidem siřičitým (viz obrázek vpravo).[6] Reakce je druhého řádu v oxidu siřičitém, protože další molekula oxidu siřičitého se pravděpodobně váže na přechodový stav a pomáhá jej stabilizovat.[7] Podobné výsledky byly nalezeny ve studii z roku 1995, kterou použili Suarez, Sordo a Sordo ab initio výpočty ke studiu kinetické a termodynamické kontroly reakce oxidu siřičitého s 1,3-dieny.[4]
Účinky rozpouštědel
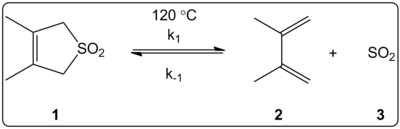
Účinek rozpouštědla cheletropické reakce 3,4-dimethyl-2,5-dihydrothiofen-1,1-dioxidu (zobrazený vpravo) byl kineticky zkoumán ve 14 rozpouštědlech. The konstanty reakční rychlosti dopředné a zpětné reakce kromě rovnovážné konstanty bylo zjištěno, že jsou lineárně korelované s ET(30) stupnice polarity rozpouštědla.
Reakce byly prováděny při 120 ° C a byly studovány 1H-NMR spektroskopií reakční směsi. Dopředná sazba k1 bylo zjištěno, že poklesl o faktor 4,5, který šel z cyklohexan na methanolu. Zpětná sazba k−1 bylo zjištěno, že vzrostl o faktor 53, který šel z cyklohexan na methanolu, zatímco rovnovážná konstanta Kekv snížena o faktor 140. Předpokládá se, že během procesu aktivace dojde ke změně polarity, jak dokazují korelace mezi rovnovážnými a kinetickými daty. Autoři poznamenávají, že se zdá, že reakce je ovlivněna polaritou rozpouštědla, což lze vysvětlit změnou dipólových momentů při přechodu z reaktantu do stavu přechodu na produkt. Autoři také uvádějí, že se nezdá, že by na cheletropickou reakci měla vliv kyselost nebo zásaditost rozpouštědla.
Výsledky této studie vedou autory k očekávání následujícího chování:
1. Změna polarity rozpouštědla ovlivní rychlost menší než rovnováha.
2. Konstanty rychlosti budou charakterizovány opačným účinkem na polaritu: k1 s nárůstem E mírně poklesneT(30) a k−1 se zvýší za stejných podmínek.
3. Účinek na k−1 bude větší než na k1.[8]
Přísady karbenu do alkenů
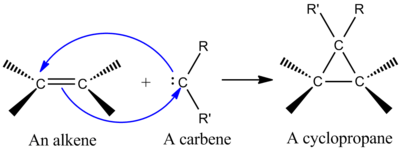
Jednou z synteticky nejdůležitějších cheletropických reakcí je přidání singletu karben na alken, aby se cyklopropan (viz obrázek vlevo).[2] Karben je neutrální molekula obsahující dvojmocný uhlík se šesti elektrony ve své valenční skořápce. Díky tomu jsou karbeny vysoce reaktivní elektrofily a vytvářejí se jako reakční meziprodukty.[9] Karamel pro singlet obsahuje prázdný str orbitální a zhruba sp2 hybridní orbitál, který má dva elektrony. Singletové karbeny se stereospecificky přidávají k alkenům a v cyklopropanovém produktu se zachovává stereochemie alkenů.[2] Mechanismus přidání karbenu k alkenu je koordinovaná [2 + 1] cykloadice (viz obrázek). K přidání CX lze použít karbeny odvozené od chloroformu nebo bromoformu2 na alken za vzniku dihalocyklopropanu, zatímco Simmons-Smith činidlo přidá CH2.[10]

Interakce naplněného karbenového orbitalu se systémem alken π vytváří systém čtyř elektronů a upřednostňuje nelineární přístup. Je také výhodné karben smíchat prázdný str orbitál s naplněným alkenem π orbitál. K příznivému míchání dochází nelineárním přístupem (viz obrázek vpravo). Přestože teorie jednoznačně upřednostňuje nelineární přístup, neexistují žádné zjevné experimentální důsledky pro lineární vs. nelineární přístup.[2]
Reference
- ^ Chelotropní reakce Zlatá kniha IUPAC
- ^ A b C d E F Eric V. Anslyn a Dennis A. Dougherty Moderní fyzikální organická chemie University Science Books, 2006.
- ^ Ian Fleming. Frontier Orbitals and Organic Chemistry Reactions. Wiley, 1976.
- ^ A b Suarez, D .; Sordo, T. L .; Sordo, J. A. (1995). „Srovnávací analýza mechanismů cheltrotropních a Diels-Alderových reakcí 1,3-dienů s oxidem sírovým: kinetické a termodynamické kontroly“. J. Org. Chem. 60 (9): 2848–2852. doi:10.1021 / jo00114a039.
- ^ Isaacs, N. S .; Laila, A. A. R. (1976). "Sazby přidání oxidu siřičitého k některým 1,3-dienům". Tetrahedron Lett. 17 (9): 715–716. doi:10.1016 / S0040-4039 (00) 74605-3.
- ^ A b Monnat, F .; Vogel, P .; Sordo, J. A. (2002). "Hetero-Diels-Alder and Cheletropic Přídavky oxidu siřičitého k 1,2-dimethylidenecykloalkanům. Stanovení termochemických a kinetických parametrů pro reakce v roztoku a srovnání s odhady z kvantových výpočtů". Helv. Chim. Acta. 85 (3): 712–732. doi:10.1002 / 1522-2675 (200203) 85: 3 <712 :: AID-HLCA712> 3.0.CO; 2-5.
- ^ Fernandez, T .; Sordo, J. A .; Monnat, F .; Deguin, B .; Vogel, P. (1998). „Oxid siřičitý podporuje své heterodiels-olše a cheltrotropní přísady do 1,2-dimethylidenecyklohexanu“. J. Am. Chem. Soc. 120 (50): 13276–13277. doi:10.1021 / ja982565p.
- ^ Desimoni, G .; Faita, G .; Garau, S .; Righetti, P. (1996). „Solventní účinek v pericyklických reakcích. X. Cheletropická reakce“. Čtyřstěn. 52 (17): 6241–6248. doi:10.1016/0040-4020(96)00279-7.
- ^ John McMurry Organic Chemistry, 6. vydání. Thomson, 2004.
- ^ Robert B. Grossman Umění psaní rozumných mechanismů organické reakce Springer, 2003.

![{ displaystyle { frac {d [3]} {dt}} = k_ {2} [1] [{ ce {SO2}}] ^ {2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/daf1918f0d2b67189681e12fe5b4bb71b0920384)