Zaurategrast - Zaurategrast
 | |
| Klinické údaje | |
|---|---|
| Ostatní jména | CDP323 |
| Právní status | |
| Právní status |
|
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| Řídicí panel CompTox (EPA) | |
| Informační karta ECHA | 100.158.922 |
| Chemické a fyzikální údaje | |
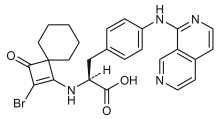
| Vzorec | C26H25BrN4Ó3 |
| Molární hmotnost | 521.415 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
Zaurategrast (CDP323) je malá molekula proléčivo antagonista z molekula adheze vaskulárních buněk 1 (VCAM-1) vazba na α4-integriny. To bylo původně vyvinuto britský biofarmaceutická společnost Celltech plc. (Nyní UCB S.A. ) a byl a domnělý nový lék pro ústní léčba roztroušená skleróza.[1]
V říjnu 2006 UCB a Biogen Idec oznámila spolupráci na společném vývoji a komercializaci zaurategrastu pro léčbu roztroušená skleróza a další potenciál indikace.[2] V červnu 2009 byl vývoj zaurategrastu zastaven kvůli odrazujícím výsledkům fáze II klinické hodnocení.[3]
Mechanismus účinku
The mechanismus účinku věřilo, že spoléhají na prevenci imunitní buňky migrovat z cévy skrz stěny lodi dosáhnout různých zanícený papírové kapesníky, včetně mozek. Předpokládá se, že tento mechanismus brání překročení imunitních reakcí a následnému poškození tkáně, jak je vidět při nekontrolované migraci imunitních buněk, jako u roztroušené sklerózy. Zaurategrast má stejný mechanismus působení jako monoklonální protilátka natalizumab.
Výsledky na zvířecích modelech
Zaurategrast byl zkoumán chronicky experimentální autoimunitní encefalomyelitida (EAE) v myši. Lék byl při podání účinný profylakticky (tj. před choroba byla indukována u myší) a pokud byla podána terapeuticky (tj. po propuknutí nemoci) a významně snížila závažnost onemocnění.[4]
Klinický vývoj
Bezpečnost, snášenlivost, a farmakokinetické profil zaurategrastu byly hodnoceny u 75 zdravých dobrovolnic žen a mužů ve třech samostatných studiích fáze 1. Zaurategrast byl dobře snášen při perorálních dávkách až 1 000 mg podávaných dvakrát denně po dobu 7 po sobě dny s nepříznivá událost profil srovnatelný s profilem pozorovaným u placebo. Nebyl žádný vliv na pohlaví. Výsledkem bylo orální podání inhibice vazby VCAM-1, která by mohla být udržována po dobu 12 nebo 24 hodinového intervalu dávek při dobře tolerovaných dávkách[5]
Studie fáze 2 byla zahájena v červnu 2007 v roce 2006 Evropa a v NÁS. Cílem studie je zahrnout více než 200 pacientů s relabující RS, u nichž selhala dřívější léčba pomocí interferon-beta a porovná dvě dávky léku s placebem po dobu šesti měsíců. Výsledky se očekávají do konce roku 2008.,[6][7] Předběžná prozatímní analýza účinnosti ukázala, že u pacientů zařazených do této klinické studie nebyl po šestiměsíčním období léčby zaurategrast ve srovnání s placebem přínosem, jak se očekávalo. Nebyly zaznamenány žádné případy progresivní multifokální leukoencefalopatie.[3]
Reference
- ^ Davenport RJ, Munday JR (červenec 2007). „Antagonismus alfa-4-integrinu - efektivní přístup k léčbě zánětlivých onemocnění?“. Objev drog dnes. 12 (13–14): 569–76. doi:10.1016 / j.drudis.2007.05.001. PMID 17631252.
- ^ Tisková zpráva UCB S.A. 2. října 2006; přistupováno 11. září 2007
- ^ A b UCB: ukončení výzkumu týkajícího se CDP323.
- ^ Watt G, Gauden V, McNeil K a kol. Vliv CDP323, malé molekuly antagonisty VLA-4, na chronickou experimentální alergickou encefalomyelitidu u myší C57Bl / 6. ECTRIMS 2005; přístup 11. září 2007
- ^ Baker M, Shock A, Parton T a kol. Farmakokinetické a farmakodynamické vlastnosti inhibitoru VLA-4 CDP323. ECTRIMS 2006; přístup 11. září 2007
- ^ Tisková zpráva UCB S.A. 26. června 2007; přistupováno 11. září 2007
- ^ Clinicaltrial.gov Vstup; přistupováno 11. září 2007
