Přepis smyčky zpětné vazby - Transcription translation feedback loop - Wikipedia
Přepis-překladová zpětnovazební smyčka (TTFL), je mobilní model pro vysvětlení cirkadiánní rytmy v chování a fyziologie. Široce konzervovaný napříč druhy je TTFL autoregulační, ve kterém je transkripce hodinových genů regulována jejich vlastními proteinovými produkty.
Objev
Cirkadiánní rytmy byly dokumentovány po staletí. Například francouzský astronom Jean-Jacques d’Ortous de Mairan zaznamenal pravidelný 24hodinový pohyb Mimóza listy rostlin již v roce 1729. Věda však teprve nedávno začala odhalovat buněčné mechanismy odpovědné za řízení pozorovaných cirkadiánních rytmů. Skutečnost, že rytmy byly pozorovány u, podporuje buněčný základ cirkadiánních rytmů jednobuněčné organismy[1]
Počínaje sedmdesátými léty prováděly experimenty Ron Konopka a kolegové, ve kterých dopředné genetické metody byly použity k vyvolání mutace, odhalila to Drosophila melanogaster vzorky se změněnými doba (Za) geny také prokázal změněnou periodicitu. Jak se zlepšily experimentální nástroje genetické a molekulární biologie, vědci dále identifikovali geny podílející se na udržování normálního rytmického chování, což vedlo k konceptu, že vnitřní rytmy jsou modifikovány malou podmnožinou genů základních hodin. Hardin a kolegové (1990) jako první navrhli, aby mechanismem pohánějícím tyto rytmy byla smyčka negativní zpětné vazby. Následné velké objevy tento model potvrdily; zejména experimenty vedené Thomasem K. Darlingtonem a Nicholasem Gekakisem na konci 90. let, které identifikovaly hodinové proteiny a charakterizovaly jejich metody u Drosophily a myší. Tyto experimenty vedly k modelu transkripčně-translační zpětnovazební smyčky (TTFL), který se nyní stal dominantním paradigmatem pro vysvětlení cirkadiánního chování u široké škály druhů.[2]
Obecné mechanismy TTFL
TTFL je smyčka negativní zpětné vazby, ve kterých jsou hodinové geny regulovány svými bílkovinnými produkty. Obecně TTFL zahrnuje dvě hlavní složky: pozitivní regulační prvky, které podporují transkripce a proteinové produkty, které potlačují transkripci. Když se pozitivní regulační prvek váže na hodiny promotor genů, přepis pokračuje, což má za následek vytvoření mRNA přepis a poté překlad postupuje, což vede k proteinovému produktu. Mezi akumulací transkriptů mRNA, akumulací proteinů a supresí genů v důsledku dynamiky translace jsou charakteristické zpoždění, posttranslační modifikace proteinu, dimerizace proteinů a intracelulární cestování do jádro.[3] Napříč druhy obsahují proteiny zapojené do TTFL běžné strukturní motivy, jako jsou PAS domény, podílející se na interakcích protein-protein, a bHLH domény podílí se na vazbě DNA.[4]
Jakmile se v DNA nahromadí dostatek modifikovaných proteinových produktů cytoplazma, jsou transportovány do jádra, kde inhibují pozitivní prvek z promotoru, aby zastavily transkripci hodinových genů. Hodinový gen je tedy transkribován na nízkých úrovních, dokud nedojde k degradaci jeho proteinových produktů, což umožňuje navázání pozitivních regulačních prvků na promotor a restart transkripce. Smyčka negativní zpětné vazby TTFL má několik vlastností důležitých pro buněčné cirkadiánní hodiny. Nejprve to vede k denním rytmům jak v transkripci genů, tak v hojnosti a velikosti proteinů, což je způsobeno zpožděním mezi translací a negativní regulací genu. Období cyklu nebo čas potřebný k dokončení jednoho cyklu zůstává u každého jedince konzistentní a kromě mutace je obvykle téměř 24 hodin. To umožňuje stabilní strhávání do 24hodinového cyklu světlo-tma, který Země zažívá. Navíc proteinové produkty hodinových genů řídí navazující geny, které nejsou součástí zpětnovazební smyčky, což umožňuje hodinovým genům vytvářet denní rytmy v jiných procesech, jako je metabolismus, v organismu.[3] A konečně, TTFL je limitní cyklus, což znamená, že se jedná o uzavřenou smyčku, která se vrátí na svou pevnou trajektorii, i když je narušena, přičemž udržuje oscilační cestu na své pevné 24hodinové periodě.[5]
Prominentní modely
Přítomnost TTFL je u druhů zvířat vysoce zachována; mnoho hráčů zapojených do procesu se však během evolučního času u různých druhů změnilo. Existují rozdíly v genech a bílkovinách zapojených do TTFL při srovnání rostlin, zvířat, hub a jiných eukaryot. To naznačuje, že hodiny, které následují model TTFL, se během existence života několikrát vyvinuly.[6]
| Drosophila melanogaster | |
|---|---|
| Pozitivní regulační orgány | CYC, hodiny |
| Negativní regulační orgány | TIM, PER |
| Savci | |
| Pozitivní regulační orgány | BMAL1, HODINY |
| Negativní regulační orgány | PER1, PER2, CRY1, CRY2 |
| Neurospora | |
| Pozitivní regulační orgány | WC-1. WC-2 |
| Negativní regulační orgány | FRQ |
Drosophila melanogaster
TTFL byl poprvé objeven v Drosophilaa systém sdílí několik komponent se savčím TTFL. Přepis genů hodin, Doba (za) a Timeless (tim), je zahájeno, když jsou pozitivní prvky Cyklus (dCYC) a Hodiny (dCLK) tvoří heterodimer a váže se Předkladatelé e-boxů, zahájení transkripce. Během dne je TIM degradován; světelná expozice usnadňuje působení CRY na TIM, což vede k ubikvitinaci TIM a eventuální degradaci.[7] Během noci jsou TIM a PER schopné tvořit heterodimery a akumulovat se pomalu v cytoplazmě, kde je PER fosforylován kinázou DVOJNÁSOBKA (DBT). Post-transkripční modifikace více fosfátových skupin se zaměřuje na komplex pro degradaci a usnadňuje nukleární lokalizaci. V jádru se dimer PER-TIM váže na dimer CYC-CLK, což uvolňuje dimer CYC-CLK z E-boxů a inhibuje transkripci. Jakmile se PER a TIM rozloží, dimery CYC-CLK jsou schopny znovu vázat E-boxy k zahájení transkripce a uzavření smyčky negativní zpětné vazby.[8]
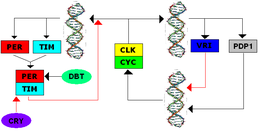
Sekundární zpětnovazební smyčky interagují s touto primární zpětnovazební smyčkou. CLOCKWORK ORANGE (CWO) váže E-boxy, aby fungovaly jako přímý konkurent CYC-CLK, a proto inhibuje transkripci. PAR-DOMAIN PROTEIN 1 ε (PDP1ε) je zpětnovazebný aktivátor a VRILLE (VRI) je zpětnovazebný inhibitor promotoru Clk a jejich exprese je aktivována dCLK-dCYC. Inhibuje protein 75 (E75) indukovaný ekdysonem clk výraz a Tim-závisle se aktivuje per transkripce. Všechny tyto sekundární smyčky posilují primární TTFL.[8]
Kryptochrom v Drosophila je fotoreceptor modrého světla, který spouští degradaci TIM, což nepřímo vede k vynulování fáze hodin a obnovené podpoře za výraz.[8]
Savci
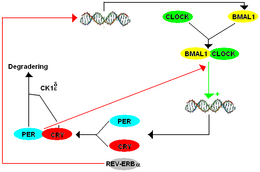
Savčí model TTFL obsahuje mnoho komponent, které jsou homology těch, které se nacházejí v Drosophile. Systém savců funguje takhle BMAL1 tvoří heterodimer s HODINY zahájit transkripci mPer a kryptochrom (plakat). Existují tři paralogy nebo historicky podobné geny, které se nyní jeví jako duplikace doba gen u savců uvedených jako mPer1, mPer2, a mPer3. U savců existují také dva paralogy kryptochromu. Proteiny PER a CRY tvoří heterodimer a fosforylace PER pomocí CK1δ a CK1ε reguluje lokalizaci dimeru do jádra. V jádru PER-CRY negativně reguluje transkripci svých příbuzných genů vazbou BMAL1-CLOCK a způsobuje jejich uvolňování z promotoru E-box.[8]
Ačkoliv mPer paralogy spolupracují jako funkční ortolog dPer, každý má odlišnou funkci. mPer1 a mPer2 jsou nezbytné pro funkci hodin v mozku, zatímco mPer3 hraje pouze rozpoznatelnou roli v cirkadiánních rytmech periferních tkání. Vyřazení buď mPer1 nebo mPer2 způsobí změnu období s mPer1 knockouty volně běžící s kratší dobou a mPer2 vyřazení volného běhu s delší dobou ve srovnání s původním tau, než se nakonec stane arytmickým. Podobně, mCry1 vyřazení má za následek zkrácení období a mCry2 vyřazení má za následek prodloužení období s dvojnásobkem mCry1/ mCry2 vyřazení vede k arytmii.[8]
U savců existují také sekundární smyčky, i když jsou složitější než ty, které jsou vidět v Drosophila. Jako CWO v Drosophila, Vymazáno u rakoviny jícnu1,2 (1. prosince 2. prosince) potlačeno mPer výraz vázáním E-boxů, které zabrání CLOCK-BMAL1 ve vázání jejich cílů. Receptory REV-ERB a KYSELINA RETINOOVÁ SOUVISEJÍCÍ ORPHAN RECEPTOR (ROR) hrají podobnou roli jako PDP1ε a VRI v Drosophila, kromě toho, že regulují vazebného partnera CLOCK BMAL1 namísto přímé regulace CLOCK. D-ELEMENT BINDING PROTEIN (DBP) a E4 BINDING PROTEIN (E4BP4) se váží na D-Box promotorovou sekvenci k regulaci mPer výraz.[8]
Způsob, jakým tyto geny souvisejí Drosophila melanogaster je vidět na funkci každého z genů a na tom, jak se evolučně změnily. BMAL1 je ortolog z CYKLUS. To znamená, že BMAL1 a CYCLE mají zřejmě společnou historii, ale vyskytují se u různých druhů. Další příklad paralely mezi Drosophila melanogaster a savci je také vidět v plakat a mPer protože jsou funkční ortology z za a Tim.[8]
Houby: Neurospora
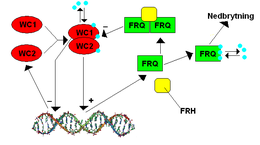
Gen frekvence (frq) v Neurospora byl identifikován jako druhý známý hodinový gen v roce 1979 JF Feldman a jeho kolegové. Frq byl poprvé naklonován v roce 1989 CR McClungem a jeho kolegy. Tento gen byl zvláště zajímavý, protože jeho exprese je ve srovnání s jinými známými mikrobiálními geny velmi složitá. Dva pozitivní regulační proteiny, BÍLÝ LÍBEK-1 (WC-1) a BÍLÝ LÍBEK-2 (WC-2) vázat promotér frq, který se nazývá Clock Box, během pozdní subjektivní noci k aktivaci transkripce. Světlo je také důležité pro vyvolání exprese FRQ; WC-1 je fotopigment a světlo umožňuje WC-1 a WC-2 vázat další promotor zvaný proximální prvek světelné odezvy (PLRE). FRQ protein negativně reguluje aktivitu WC-1 a WC-2. Několik kináz (CK1, CK2 a PRD-4 / kontrolní bod kináza 2) a fosfatáz (PP1 a PP2A) regulují schopnost FRQ translokovat do jádra a stabilitu FRQ, WC-1 a WC-2.[9]
Rostliny: Arabidopsis
První model TTFL byl navržen pro Arabidopsis v roce 2001 a zahrnoval dva transkripční faktory MYB, POZDĚJNĚ ROZDĚLENÝ HYPOCOTYL (LHY), CIRCADIAN CLOCK ASSOCIATED 1 (CCA1) a TIMING OF CAB EXPRESSION 1 (TOC1). CCA1 a LHY jsou exprimovány ráno a interagují společně, aby potlačily expresi TOC1. Exprese CCA1 a LHY ve tmě klesá, což umožňuje expresi TOC1 a negativně reguluje expresi CCA1 a LHY. CCA1 a LHY se mohou také vázat na svůj vlastní promotor, aby potlačily svou vlastní transkripci.[10]
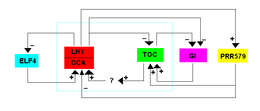
Existuje druhá smyčka zahrnující PRR9, PRR7 a PRR5, které jsou všechny homology TOC1 a potlačují expresi CCA1 a LHY. Tyto geny PRR jsou přímo potlačovány LHY a TOC1. Tyto geny jsou také regulovány „večerním komplexem“ (EC), který je tvořen LUX ARRHYTHMO (LUX), EARLY FLOWERING 3 (ELF3) a EARLY FLOWERING 4 (ELF4). LUX je transkripční faktor s podobnou funkcí jako MYB, zatímco ELF3 a ELF4 jsou jaderné proteiny, jejichž funkce nejsou známy. „Večerní komplex“ nepřímo podporuje expresi LHY a CCA1, které potlačují transkripci jeho vlastních složek. Protože tento model sestává ze dvou zábran vedoucích k aktivaci, je také označován jako represor.[10]
Nedávno objevená smyčka zahrnuje budíček (budíček) rodina genů, které jsou exprimovány ráno a indukují transkripci večerních genů, jako jsou PRR5, TOC1, LUX a ELF4. Jakmile jsou výsledné proteiny přeloženy, PRR9, PRR7 a PRR5 potlačují RVE8. RVE8 také interaguje s ranními složkami NIGHT LIGHT-INDUCIBLE AND CLOCK REGULATED (LNK1, 2, 3 a 4), s LNK buď antagonizujícími nebo koaktivujícími RVE8.[10]
Ačkoli GIGANTEA (GI) není známa jako hlavní součást EU Arabdopsis Model TTFL je potlačován CCA1, LHY a TOC1. Navíc GI aktivuje expresi CCA1 a LHY.[10]
Sinice
Studie hodin sinic vedly k objevu tří základních genů hodin: KaiA, KaiB, a KaiC. Původně se předpokládalo, že tyto proteiny následují model TTFL podobný tomu, který byl navržen pro eukarya, protože existoval denní vzorec v nadbytku mRNA a proteinů a úrovni fosforylace, negativní zpětná vazba proteinů na jejich příbuzné geny, resetování hodinové fáze v reakci na nadměrnou expresi KaiC a modifikovaná aktivita Kai prostřednictvím vzájemných interakcí.[11] Každý z těchto výsledků byl v souladu s porozuměním TTFL v té době. Pozdější studie však od té doby dospěly k závěru, že posttranslační úpravy, jako je fosforylace, jsou pro řízení hodin důležitější. Když byly promotory pro proteiny Kai nahrazeny nespecifickými promotory, nedocházelo k přerušení centrální zpětnovazební smyčky, jak by se dalo očekávat, kdyby došlo k inhibici prostřednictvím zpětné vazby proteinů na jejich specifické promotory. V důsledku toho byl model TTFL z velké části stanoven jako nepřesný pro sinice; transkripční regulace není ústředním procesem, který řídí rytmy sinic. Ačkoli transkripční a translační regulace jsou přítomny, byly považovány spíše za účinky hodin, než aby byly nutné pro funkci hodin.[12]
Alternativy k modelu TTFL
Byly také odhaleny posttranslační zpětnovazební smyčky (PTFL) zapojené do regulace hodinových genů, které často fungují v tandemu s modelem TTFL. U savců i rostlin regulují hojnost a / nebo aktivitu hodinových genů a proteinů posttranslační modifikace, jako je fosforylace a acetylace. Ukázalo se například, že hladiny fosforylace složek TTFL se rytmicky mění. Tyto posttranslační modifikace mohou sloužit jako degradační signály, regulátory vazby a signály pro nábor dalších faktorů.[13]
Zejména sinice ukazují rytmické 24hodinové změny ve fosforylaci ve zpětnovazební smyčce, která je nezávislá na transkripci a translaci: cirkadiánní rytmy ve fosforylaci jsou pozorovány, když jsou zpětnovazební smyčky Kai proteiny umístěny do zkumavky s ATP, nezávisle na jakémkoli jiném buněčném stroji . Tento posttranslační systém se třemi proteiny je všeobecně přijímán jako základní oscilátor, jak nezbytný, tak postačující k řízení denních rytmů.[14] Kromě systému Kai v sinicích bylo prokázáno, že oxidace proteinů peroxiredoxinu probíhá nezávisle na transkripci a translaci jak v červených krvinkách savců, tak v řasách Ostreococcus tauri buňky; tento systém byl v mnoha organismech považován za konzervovaný.[15] Není jasné, zda systém peroxiredoxinu interaguje s hodinami založenými na TTFL, nebo je sám součástí nových hodin založených na PTFL. Obě tato zjištění však naznačují, že u některých organismů nebo typů buněk jsou PTFL dostačující k řízení cirkadiánních rytmů.
Viz také
Reference
- ^ Mergenhagen D (2001). "Cirkadiánní rytmy v jednobuněčných organismech". Aktuální témata v mikrobiologii a imunologii. Příručka behaviorální neurobiologie. Springer USA. 90: 123–47. doi:10.1007/978-1-4615-1201-1_4. ISBN 9781461512011. PMID 6775877.
- ^ Wulund L, Reddy AB (prosinec 2015). „Stručná historie cirkadiánního času: Vznik redoxních oscilací jako nové složky biologických rytmů“. Perspektivy ve vědě. 6: 27–37. doi:10.1016 / j.pisc.2015.08.002.
- ^ A b Hastings MH, Maywood ES, O'Neill JS (září 2008). "Buněčná cirkadiánní kardiostimulace a role cytosolických rytmů". Aktuální biologie. 18 (17): R805 – R815. doi:10.1016 / j.cub.2008.07.021. PMID 18786386.
- ^ Dunlap JC, Loros JJ, Liu Y, Crosthwaite SK (leden 1999). "Eukaryotické cirkadiánní systémy: společné cykly". Geny do buněk. 4 (1): 1–10. doi:10.1046 / j.1365-2443.1999.00239.x. PMID 10231388.
- ^ Sheredos B (2013). „Vědecké diagramy jako stopy poznání závislého na skupině: krátká kognitivně-historická analýza“. Sborník z výročního zasedání Společnosti kognitivních věd. 35 (35).
- ^ Loudon AS (červenec 2012). „Cirkadiánní biologie: 2,5 miliardy let staré hodiny“. Aktuální biologie. 22 (14): R570-1. doi:10.1016 / j.cub.2012.06.023. PMID 22835791.
- ^ Yoshii T, Hermann-Luibl C, Helfrich-Förster C (01.01.2016). „Circadian light-input draways in Drosophila“. Komunikativní a integrativní biologie. 9 (1): e1102805. doi:10.1080/19420889.2015.1102805. PMC 4802797. PMID 27066180.
- ^ A b C d E F G Andreani TS, Itoh TQ, Yildirim E, Hwangbo DS, Allada R (prosinec 2015). „Genetika cirkadiánních rytmů“. Kliniky spánkové medicíny. 10 (4): 413–21. doi:10.1016 / j.jsmc.2015.08.007. PMC 4758938. PMID 26568119.
- ^ Dunlap JC, Loros JJ, Colot HV, Mehra A, Belden WJ, Shi M, Hong CI, Larrondo LF, Baker CL, Chen CH, Schwerdtfeger C, Collopy PD, Gamsby JJ, Lambreghts R (2007). „Cirkadiánní hodiny v Neurosporu: jak geny a proteiny spolupracují na produkci trvalého, strhatelného a kompenzovaného biologického oscilátoru po dobu asi jednoho dne“. Cold Spring Harbor Symposia o kvantitativní biologii. 72: 57–68. doi:10,1101 / sqb.2007.72.072. PMC 3683860. PMID 18522516.
- ^ A b C d Sanchez SE, Kay SA (prosinec 2016). „The Circadian Clock: From a Simple Timekeeper to a Complex Development Manager“. Perspektivy Cold Spring Harbor v biologii. 8 (12): a027748. doi:10.1101 / cshperspect.a027748. PMC 5131769. PMID 27663772.
- ^ Johnson CH, Mori T, Xu Y (září 2008). „Cirkadiánní hodinový stroj sinic“. Aktuální biologie. 18 (17): R816 – R825. doi:10.1016 / j.cub.2008.07.012. PMC 2585598. PMID 18786387.
- ^ Sheredos B (2013). „Vědecké diagramy jako stopy poznání závislého na skupině: krátká kognitivně-historická analýza“. Sborník z výročního zasedání Společnosti kognitivních věd. 35 (35).
- ^ Kojima S, Shingle DL, Green CB (únor 2011). "Post-transkripční kontrola cirkadiánních rytmů". Journal of Cell Science. 124 (Pt 3): 311–20. doi:10.1242 / jcs.065771. PMC 3021995. PMID 21242310.
- ^ Hurley JM, Loros JJ, Dunlap JC (říjen 2016). „Circadian Oscillators: Around the Transcription-Translation Feedback Loop and on to Output“. Trendy v biochemických vědách. 41 (10): 834–846. doi:10.1016 / j.tibs.2016.07.009. PMC 5045794. PMID 27498225.
- ^ Brown SA, Kowalska E, Dallmann R (březen 2012). „(Re) vynalézání cirkadiánní zpětnovazební smyčky“. Vývojová buňka. 22 (3): 477–87. doi:10.1016 / j.devcel.2012.02.007. PMID 22421040.
