Deuterovaný chloroform - Deuterated chloroform - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC trichlor (deuterio) metan[1] | |||
| Ostatní jména Chloroform-d Deuterochloroform | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| 1697633 | |||
| ChEBI | |||
| ChemSpider | |||
| Informační karta ECHA | 100.011.585 | ||
| Číslo ES |
| ||
PubChem CID | |||
| UNII | |||
| UN číslo | 1888 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| CDCI3 | |||
| Molární hmotnost | 120,384 g mol−1 | ||
| Hustota | 1 500 g cm−3 | ||
| Bod tání | -64 ° C (-83 ° F; 209 K) | ||
| Bod varu | 61 ° C (142 ° F; 334 K) | ||
| Nebezpečí | |||
| Piktogramy GHS |    | ||
| Signální slovo GHS | Nebezpečí | ||
| H302, H315, H319, H331, H336, H351, H361, H372, H373 | |||
| P201, P202, P260, P261, P264, P270, P271, P280, P281, P301 + 312, P302 + 352, P304 + 340, P305 + 351 + 338, P308 + 313, P311, P312, P314, P321, P330, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |||
| NFPA 704 (ohnivý diamant) | |||
| Související sloučeniny | |||
Související sloučeniny | Chloroform | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
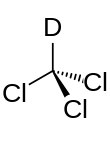
Deuterovaný chloroform (CDCI3), také známý jako chloroformd, je izotopově obohaceno druh chloroform (CHCI3) ve kterém většina jeho vodík atomy se skládají z těžších nuklid deuterium (těžký vodík) (D = 2H) spíše než přirozené izotopový směs, ve které protium (1H) převládá.[2] Zdaleka nejběžnější je deuterovaný chloroform solventní použito v NMR spektroskopie.[3] Zatímco dichlormethan a chloroform (trichlormethan) jsou obě běžně používaná rozpouštědla, která rozpouštějí širokou škálu dalších organických sloučenin, deuterovaný chloroform se vyrábí snadněji a je mnohem levnější než deuterovaný dichlormethan.[4] Kromě toho je chemicky nereaktivní a je nepravděpodobné, že by vyměňoval své deuterium za rozpuštěnou látku, a jeho nízký bod varu umožňuje snadnou regeneraci vzorku.[Citace je zapotřebí ]
Vlastnosti CDCl3 jsou prakticky identické s těmi jako u běžného chloroformu, i když biologicky je pro játra o něco méně toxický než CHCl3, díky své vazbě C – D, která je silnější než vazba C – H, takže je poněkud méně náchylný k tvorbě destruktivního trichlormethylového radikálu (• CCl3).[5]
NMR rozpouštědlo
v protonová NMR spektroskopie, musí se použít deuterované rozpouštědlo (obohacené na> 99% deuteria), aby se zabránilo záznamu velkého rušivého signálu nebo signálů z protonu (ů) (tj. vodíku-1) přítomného v samotném rozpouštědle. Pokud by byl jako rozpouštědlo použit nedeuterovaný chloroform (obsahující plný ekvivalent protia), signál rozpouštědla by téměř jistě přemohl a zakryl všechny blízké signály analytu. Kromě toho moderní přístroje obvykle vyžadují přítomnost deuterovaného rozpouštědla, protože frekvence pole je blokována pomocí deuteriového signálu rozpouštědla, aby se zabránilo driftu frekvence. Komerční chloroformd stále však obsahuje malé množství (0,2% nebo méně) nedeuterovaného chloroformu; toto vede k malému singletu o 7,26 ppm, známému jako pík zbytkového rozpouštědla, který se často používá jako interní referenční chemický posun.
v uhlík-13 NMR spektroskopie, jediný uhlík v deuterovaném chloroformu vykazuje triplet při a chemický posun 77,16 ppm, přičemž tři vrcholy mají přibližně stejnou velikost, což je výsledkem dělení na točit spojku k připojenému atomu deuteria spin-1 (CHCI3 má chemický posun 77,36 ppm).[4]
Reaguje fotochemicky s kyslíkem za vzniku fosgen a chlorovodík. Dražší alternativy jako dichlormethan-d2 nebo benzen-d6 musí se použít, pokud se očekává, že analyt bude vysoce citlivý na kyseliny. Aby se tento proces zpomalil a snížila se kyselost rozpouštědla, chloroformd je skladován v hnědých tónovaných lahvích, často na malém množství neutralizačního základu Uhličitan draselný.[Citace je zapotřebí ]
Nebezpečí
Jako nedeuterovaný chloroform, chloroformd je hepatotoxický a pravděpodobně bude karcinogenní. Navíc vystavení světlu a kyslíku vede k tvorbě vysoce toxických látek fosgen.
Reference
- ^ https://pubchem.ncbi.nlm.nih.gov/compound/Chloroform-D
- ^ Protože neobohaceným vodíkem je většinou protium (99,85%), pouze se stopou deuteria (0,15%), toto obohacení deuteriem je hovorově, i když poněkud nepřesně, popsáno jako „nahrazení“ vodíku („H“) deuteriem ( „D“).
- ^ Fulmer, Gregory R .; Miller, Alexander J. M .; Sherden, Nathaniel H .; Gottlieb, Hugo E .; Nudelman, Abraham; Stoltz, Brian M .; Bercaw, John E .; Goldberg, Karen I. (2010). „NMR chemické posuny stopových nečistot: běžná laboratorní rozpouštědla, organická rozpouštědla a plyny v deuterovaných rozpouštědlech relevantní pro organokovové chemikálie“ (PDF). Organometallics. 29 (9): 2176–2179. doi:10.1021 / om100106e.
- ^ A b Teorie NMR - rozpouštědla pro NMR spektroskopii
- ^ Goldstein, Robin S. (2013). Toxické interakce. Hewitt, William R., Hook, Jerry B. Burlington: Elsevier Science. ISBN 978-1-4832-6970-2. OCLC 896796140.