Spirotryprostatin B - Spirotryprostatin B
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Vlastnosti | |
| C21H21N3Ó3 | |
| Molární hmotnost | 363,41 g / mol |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Spirotryprostatin B je indolický alkaloid nalezen v Aspergillus fumigatus houba, která patří do třídy přirozeně se vyskytujících 2,5-diketopiperaziny.[1] Spirotryprostatin B a několik dalších indolických alkaloidů (včetně Spirotryprostatin A, stejně jako další tryprostatiny a cyklotryprostatiny) mají anti-mitotický vlastnosti, a jako takové se staly velmi zajímavými jakorakovina léky.[2] Z tohoto důvodu celkové syntézy těchto sloučenin je hlavním cílem organických chemiků a v chemické literatuře byla publikována řada různých syntéz.
Celková syntéza
První úplná syntéza byla provedena v roce 2000 skupinou Danishefsky v Columbia University,[3] s řadou dalších syntéz, které Williams následoval krátce poté,[4] Ganesan,[5] Fuji,[6] Carreira,[7] Horne,[8] Overman,[9] a naposledy Trost.[10]
Ze syntetického hlediska jsou nejnáročnějšími strukturními rysy molekuly C3 spirocyklický kruhový spoj a sousední prenyl-substituovaný uhlík. Přístupy k přípravě kostry spirotryprostatinu B se značně lišily.
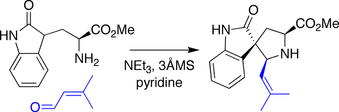
Danishefskyho spirotryprostatin B syntéza
V Danishefského syntéze je amin odvozen od tryptofan byl kondenzován s aldehyd, spouštění a Mannichův typ reakce, kde přívěsek oxindol choval se jako nukleofil směrem k meziproduktu iminium druh.
Syntéza spirotryprostatinu B. Williams
Syntéza Williamsovou skupinou využila 3-komponentní kopulační reakci. Sekundární amin byl kombinován s aldehyd za vzniku meziproduktu azomethinu ylid, který podstoupil a 1,3-dipolární cykloadice s nenasycenými oxindol také přítomné v reakční směsi.
Ganesanová syntéza spirotryprostatinu B.
Ganesan využil a biomimetický strategie v jeho syntéze spirotryprostatinu B. An indol byl ošetřen N-bromsukcinimid spustit oxidativní přesmyk a vytvořit kvartér stereocentrum v diastereoselektivní způsob.
Syntéza fuji spirotryprostatinu B.
V syntéze vyvinuté skupinou Fuji, stereochemie na spirocyklický uhlík byl stanoven nitroolefinační reakcí. An oxindol s přívěskovou prenylovou skupinou reagoval s nitroolefinem nesoucím a chirální opouštějící skupina.
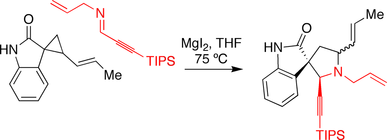
Syntéza spirotryprostatinu B Carreira
Skupina Carreira využila při svém přístupu k spirotryprostatinu B annulační reakci podporovanou jodidem hořečnatým. oxindol nesoucí a cyklopropan reagoval s já těžím v přítomnosti jodidu hořečnatého, čímž se spustí reakce expanze kruhu.
Syntéza horního spirotryprostatinu B.
Hornova syntéza spirotryprostatinu B také využila a Mannichův typ proces, při kterém seindol sloužil jako pro-nukleofil. Cyklizace byla spuštěna ošetřením přívěsku já těžím s acylchlorid odvozený od prolin. Výsledný iminium druh byl napaden chloro-indol, tvořící spirocyklický pouto.
Syntéza spirotryprostatinu B Overman
Skupina Overman využila a Heck reakce připravit molekulu. Jodoanilin s uvázaným alken byl podroben palladium katalýza. Meziprodukt palladium-allyl byl zachycen přívěskem amide dusíku za vzniku prenylu stereocentrum ve stejné reakci.
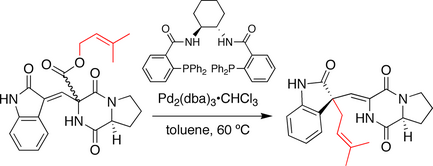
Trostová syntéza spirotryprostatinu B.
Při syntéze vyvinuté skupinou Trost byla stereochemie na spirocyklický kruhové spojení je stanoveno dekarboxylační-prenylační sekvencí, připomínající Carrollova reakce. Zde prenylester slouží jako oba nukleofil a elektrofil předchůdce. Po léčbě a chirální palladiový katalyzátor prenylová skupina ionizuje a dekarboxyláty. Výsledný ion pár následně rekombinuje za vzniku prenylovaného produktu. Je pozoruhodné, že dochází k migraci dvojných vazeb a prenylová skupina je napadena na oxindol uhlík.
Reference
- ^ Borthwick AD; et al. (2012). „2,5-Diketopiperaziny: syntéza, reakce, léčivá chemie a bioaktivní přírodní produkty“. Chemické recenze. 112 (7): 3641–3716. doi:10.1021 / cr200398y. PMID 22575049.
- ^ Cui, CB (1996). "Spirotryprostatin B, nový inhibitor buněčného cyklu savců produkovaný Aspergillus fumigatus". J. Antibiot. 49 (8): 832–835. doi:10,7164 / antibiotika. 49,832. PMID 8823522.
- ^ von Nussbaum, F; Danishefsky, SJ (2000). „Rychlá celková syntéza spirotryprostatinu B: důkaz jeho relativní a absolutní stereochemie“. Angew. Chem. Int. Vyd. 39 (12): 2175–2178. doi:10.1002 / 1521-3773 (20000616) 39:12 <2175 :: AID-ANIE2175> 3.0.CO; 2-J. PMID 10941053.
- ^ Sebahar, PR; Williams, RM (2000). "Asymetrická celková syntéza (+) - a (-) - spirotryprostatinu B". J. Am. Chem. Soc. 122 (23): 5666–5667. doi:10.1021 / ja001133n.
- ^ Wang, H; Ganesan, A (2000). "Biomimetická celková syntéza (-) - spirotryprostatinu B a související studie". J. Org. Chem. 65 (15): 4685–4693. doi:10.1021 / jo000306o. PMID 10959875.
- ^ Bagul, TD; et al. (2002). "Celková syntéza spirotryprostatinu B prostřednictvím asymetrické nitroolefinace". Org. Lett. 4 (2): 249–251. doi:10.1021 / ol016999s. PMID 11796062.
- ^ Meyers, C; Carreira, EM (2003). "Celková syntéza (-) - spirotryprostatinu B". Angew. Chem. Int. Vyd. 42 (6): 694–696. doi:10.1002 / anie.200390192. PMID 12575009.
- ^ Miyake, FY; et al. (2004). „Příprava a syntetické aplikace methylesterů 2-halotryptofanu: syntéza spirotryprostatinu B“. Angew. Chem. Int. Vyd. 43 (40): 5357–5360. doi:10.1002 / anie.200460419. PMID 15468070.
- ^ Overman, LE; Rosen, MD (2000). "Celková syntéza (-) - spirotryprostatinu B a tří stereoizomerů". Angew. Chem. Int. Vyd. 39 (24): 4596–4599. doi:10.1002 / 1521-3773 (20001215) 39:24 <4596 :: AID-ANIE4596> 3.0.CO; 2-F.
- ^ Trost, BM; Stiles, DT (2007). "Celková syntéza spirotryprostatinu B pomocí diastereoselektivní prenylace". Org. Lett. 9 (15): 2763–2766. doi:10.1021 / ol070971k. PMID 17592853.