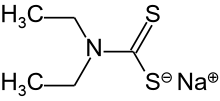
Diethyldithiokarbamát sodný - Sodium diethyldithiocarbamate
 | |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC natrium (diethylkarbamothioyl) sulfanid | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.005.192 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C5H10NS2Na | |
| Molární hmotnost | 171,259 g / mol (bezvodý) |
| Vzhled | Bílá, slabě hnědá nebo slabě růžová krystalická pevná látka |
| Hustota | 1,1 g / cm3 |
| Bod tání | 95 ° C (203 ° F; 368 K) |
| Rozpustný | |
| Rozpustnost | rozpustný v alkohol, aceton nerozpustný v éter, benzen |
| Nebezpečí | |
| Hlavní nebezpečí | Škodlivý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Diethyldithiokarbamát sodný je organosírná sloučenina se vzorcem NaS2CN (C.2H5)2.
Příprava
Tato sůl se získá zpracováním sirouhlík s diethylamin v přítomnosti hydroxid sodný:
- CS2 + HN (C.2H5)2 + NaOH → NaS2CN (C.2H5)2 + H2Ó
jiný dithiokarbamáty lze připravit podobně ze sekundárních aminů a sirouhlíku. Používají se jako chelatační činidla pro ionty přechodných kovů a jako prekurzory herbicidy a vulkanizace činidla.
Oxidace na thiuram disulfid
Oxidací diethyldithiokarbamátu sodného se získá: disulfid, také nazývaný a thiuram disulfid (Et = ethyl ):
- 2 NaS2CNEt2 + Já2 → Et2NC (S) S-SC (S) NEt2 + 2 NaI
Tento disulfid se prodává jako protialkoholismus droga pod štítky Antabuse a Disulfiram. Chlorace výše uvedeného thiuramdisulfidu poskytuje thiokarbamoylchlorid.[1]
Ligandové spojení
Itylethyldithiokarbamátový iont chelatuje mnoho "měkčí "Kovy prostřednictvím dvou atomů síry. Jsou známy i další komplikovanější způsoby vazby, včetně vazby jako neidentifikovaného ligandu a přemosťující ligand s použitím jednoho nebo obou atomů síry.[2]
Točení pastí radikálů oxidu dusnatého
Komplexy dithiokarbamátů se železem poskytují jednu z mála metod ke studiu tvorby oxid dusnatý (NO) radikály v biologických materiálech. Ačkoli je životnost NO v tkáních příliš krátká na to, aby umožnila detekci samotného tohoto radikálu, NO se snadno váže na komplexy železo-dithiokarbamát. Výsledný komplex mono-nitrosyl-železo (MNIC) je stabilní a lze jej detekovat pomocí Elektronová paramagnetická rezonance (EPR) spektroskopie.[3][4][5]
U rakoviny
The zinek chelatace diethyldithiokarbamátu inhibuje metaloproteinázy, což zase zabrání degradaci extracelulární matrix, počáteční krok v rakovině metastáza a angiogeneze.[6]
Antioxidant
Diethyldithiokarbamát inhibuje superoxiddismutáza, které mohou oba mít antioxidant a oxidační účinky na buňky, v závislosti na době podání.[6]
Reference
- ^ Goshorn, R. H .; Levis, Jr., W. W.; Jaul, E .; Ritter, E. J. (1963). "Diethylthiokarbamylchlorid". Organické syntézy.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 4, str. 307
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A .; Bochmann, Manfred (1999), Pokročilá anorganická chemie (6. vydání), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Henry Y .; Guissani A .; Ducastel B. (eds); „Výzkum oxidu dusnatého od chemie po biologii: EPR spektroskopie nitrosylovaných sloučenin.“ Landes, Austin 1997.
- ^ Vanin, A.F .; Huisman, A .; van Faassen, E.E. (2002). „Železné dithiokarbamáty jako spin spin na oxid dusnatý: úskalí a úspěchy“. Metody v enzymologii. 359: 27–42. doi:10.1016 / s0076-6879 (02) 59169-2. PMID 12481557.
- ^ van Faassen E.E .; Vanin A.F. (eds); „Radikály pro život: Různé formy oxidu dusnatého.“ Elsevier, Amsterdam 2007.
- ^ A b diethyldithiokarbamát National Cancer Institute - Drug Dictionary
Další čtení
- Cvek B, Dvořák Z (2007). „Cílení nukleárního faktoru-kappaB a proteazomu dithiokarbamátovými komplexy s kovy“. Curr. Pharm. Des. 13 (30): 3155–67. doi:10.2174/138161207782110390. PMID 17979756.
