Prolinová organokatalýza - Proline organocatalysis
Prolinová organokatalýza je použití prolin jako organokatalyzátor v organická chemie. Toto téma je často považováno za výchozí bod pro oblast organokatalýzy, i když první objevy zůstaly nedoceněné.[1] Úpravy, jako např MacMillanov katalyzátor a Jorgensenovy katalyzátory, pokračujte s vynikajícím stereokontrolem.[2]:5574[3]
Prolinová katalýza byla původně hlášena skupinami v Schering AG a Hoffmann-La Roche.[1][4][5][6] Proline chirální struktura umožňuje enantioselektivní syntéza zvýhodňování konkrétního enantiomer nebo diastereomer.[2]:5574[1][7][8][9]:47
Reakce
The Hajos – Parrish – Eder – Sauer – Wiechertova reakce, publikovaný v roce 1971 několika výzkumnými týmy, je časným příkladem enantioselektivní katalytické reakce v organické chemii.[10] Jeho rozsah byl upraven a rozšířen vývojem souvisejících reakcí včetně Michael navíc, asymetrická aldolová reakce a Mannichova reakce. Tato reakce byla rovněž použita k provedení asymetrie Robinsonovy anulace. Obecné schéma této reakce je následující:

Tento příklad ilustruje aldolizaci 6-enolendo. Prolin katalyzuje asymetrický aldolová reakce. The zwitterionický charakter a H-vazba prolin v přechodový stav určit výsledek reakce.[11][12][13][14] An enamin se tvoří během reakce a pouze jedna molekula prolin se podílí na tvorbě přechodového stavu.[15]
Asymetrická syntéza z Wieland-Miescher keton je také založen na prolin.[16] Mezi další reakce patří aldolové reakce,[17][18][19][20] Mannichova reakce,[21][22][23] Michaelova reakce,[24][25] aminace,[22] α-oxyaminace,[26][27] a a-halogenace.[28][29]
Úpravy základní struktury prolinů zlepšily enantioselektivitu a regioselektivitu katalýzy.[28][29] Tyto pomocné látky a katalyzátory odvozené od prolinů,[30] včetně Ukončuje hydrazonovou reakci a Corey – Itsuno redukce, byly zkontrolovány,[31][32] jak mají MacMillanovo iminium katalyzátory,[33] Millerovy katalyzátory,[33] a CBS-oxazaborolidiny.[34]
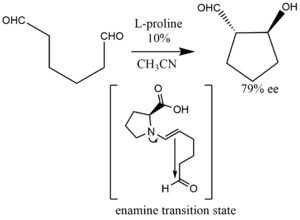
Ilustrující enolexovou intramolekulární aldolizaci může být dikarbonyl (dial, diketony) převeden na anti-aldolové produkty s 10% L-prolinovým katalyzátorem.[35][36]
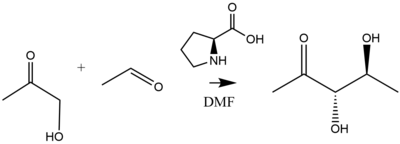
Prominentním příkladem prolinové katalýzy je přidání aceton nebo hydroxyaceton na různorodou sadu aldehydů katalyzovaných 20 až 30% prolinovým katalyzátorem s vysokou (> 99%) enantioselektivitou, čímž se získají diolové produkty.[37] Jak rafinovali List a Notz, výše uvedená reakce produkuje diolové produkty následovně:[38]
Mechanistické úvahy
Prolinem katalyzované adice aldolu probíhají prostřednictvím šestičlenného přechodného stavu enaminu podle modelu Zimmerman-Traxler. Přídavek 20 až 30% molárních prolinů k acetonu nebo hydroxyacetonu katalyzuje jejich přidání k různým souborům aldehydů s vysokou (> 99%) enantioselektivitou za vzniku diolových produktů.[39][40][41] Prolin a prolinové deriváty byly implementovány jako organokatalyzátory pro podporu asymetrických kondenzačních reakcí. Příklad takové reakce probíhající prostřednictvím šestičlenného přechodového stavu je modelován následovně.

Intramolekulární aldolizační reakce, které jsou katalyzovány prolinem, rovněž procházejí šestičlennými přechodovými stavy. Tyto přechodové stavy mohou umožnit tvorbu buď enolexo nebo enolendo produktu.[42]

Reference
- ^ A b C Gaunt, M. J .; Johansson, C. C. C .; McNally, A .; Vo, N. T. (2007). "Enantioselektivní organokatalýza". Objev drog dnes. 12 (1–2): 8–27. doi:10.1016 / j.drudis.2006.11.004. PMID 17198969.
- ^ A b List, B. (2002). "Prolinem katalyzované asymetrické reakce". Čtyřstěn. 58 (28): 5573–5590. doi:10.1016 / S0040-4020 (02) 00516-1.
- ^ Wang, Z. (2009). V části „Komplexní reakce s organickými názvy a činidla“, strana 1306, John Wiley & Sons. ISBN 0471704504, ISBN 9780471704508
- ^ Hajos, Z. G. a Parrish, D. R. (1971), německý patent DE 2102623
- ^ Eder, U .; Sauer, G .; Wiechert, R. (1971). "Nový typ asymetrické cyklizace na opticky aktivní steroidní částečné struktury CD". Angewandte Chemie International Edition v angličtině. 10 (7): 496–497. doi:10.1002 / anie.197104961.
- ^ Hajos, Z. G .; Parrish, D. R. (1974). "Syntéza a přeměna 2-methyl-2- (3-oxobutyl) -1,3-cyklopentandionu na izomerní racemické ketoly 3.2.1] bicyklooktanu a perhydroindanové řady." The Journal of Organic Chemistry. 39 (12): 1612. doi:10.1021 / jo00925a002.
- ^ Dalko, P .; Moisan, L. (2001). "Enantioselektivní organokatalýza". Angewandte Chemie International Edition. 40 (20): 3726–3748. doi:10.1002 / 1521-3773 (20011015) 40:20 <3726 :: AID-ANIE3726> 3.0.CO; 2-D.
- ^ Berkessel, A., Groeger, H. (2005). "Asymetrická organokatalýza". Wiley-VCH ISBN 3527305173
- ^ Dalko, P.I. (editor) (2007). „Enantioselektivní organokatalýza: reakce a experimentální postupy“. John Wiley & Sons. ISBN 9783527315222
- ^ Wang, Zerong (2009). Komplexní organické názvové reakce a činidla. Hoboken, N.J .: John Wiley. ISBN 9780470638859.
- ^ Hajos, Z. G .; Parrish, D. R. (1974). "Asymetrická syntéza bicyklických meziproduktů chemie přírodních produktů". The Journal of Organic Chemistry. 39 (12): 1615–1621. doi:10.1021 / jo00925a003.
- ^ Clemente, F. R.; Houk, K.N. (2004). "Výpočtové důkazy pro enaminový mechanismus intramolekulárních aldolových reakcí katalyzovaných prolinem". Angewandte Chemie. 116 (43): 5890. doi:10.1002 / ange.200460916.
- ^ List, B .; Hoang, L .; Martin, H. J. (2004). „Asymetric Catalysis Special Feature Part II: New mechanistic studies on the proline-katalyzated aldol response“. Sborník Národní akademie věd. 101 (16): 5839–5842. Bibcode:2004PNAS..101,5839L. doi:10.1073 / pnas.0307979101. PMC 395996. PMID 15073330.
- ^ Rankin, K. N .; Gauld, J. W .; Boyd, R. J. (2002). "Hustotní funkční studie přímé prolinové reakce katalyzované prolinem". The Journal of Physical Chemistry A. 106 (20): 5155. Bibcode:2002JPCA..106.5155R. doi:10.1021 / jp020079p.
- ^ Hoang, L .; Bahmanyar, S .; Houk, K. N .; List, B. (2003). „Kinetické a stereochemické důkazy o zapojení pouze jedné prolinové molekuly do přechodových stavů prolinovými a intermolekulárními aldolovými reakcemi katalyzovanými prolinem“. Journal of the American Chemical Society. 125 (1): 16–17. doi:10.1021 / ja028634o. PMID 12515489.
- ^ Woodward, R. B .; Logusch, E .; Nambiar, K. P .; Sakan, K .; Ward, D. E.; Au-Yeung, B. W .; Balaram, P .; Browne, L. J .; Card, P. J .; Chen, C. H. (1981). „Asymetrická celková syntéza erythromcinu. 1. Syntéza erythronolidu a derivátu sekokyseliny pomocí asymetrické indukce“. Journal of the American Chemical Society. 103 (11): 3210. doi:10.1021 / ja00401a049.
- ^ Northrup, A. B .; MacMillan, D. W. C. (2002). „První přímá a enantioselektivní křížová aldolová reakce aldehydů“ (PDF). Journal of the American Chemical Society. 124 (24): 6798–6799. doi:10.1021 / ja0262378. PMID 12059180.
- ^ Notz, W .; List, B. (2000). "Katalytická asymetrická syntéza anti-1,2-diolů". Journal of the American Chemical Society. 122 (30): 7386. doi:10.1021 / ja001460v.
- ^ List, B .; Pojarliev, P .; Castello, C. (2001). „Asymetrické Aldol reakce katalyzované prolinem mezi ketony a a-nesubstituovanými aldehydy“. Organické dopisy. 3 (4): 573–575. doi:10.1021 / ol006976y. PMID 11178828.
- ^ List, B .; Lerner, R. A .; Barbas, C. F. (2000). „Proline-Catalyzed Direct Asymetric Aldol Reactions“. Journal of the American Chemical Society. 122 (10): 2395. doi:10.1021 / ja994280y.
- ^ Córdova, A .; Watanabe, S .; Tanaka, F .; Notz, W .; Barbas Cf, 3. (2002). „Vysoce enantioselektivní cesta k jakémukoli enantiomeru derivátů alfa- i beta-aminokyselin“. Journal of the American Chemical Society. 124 (9): 1866–1867. doi:10.1021 / ja017833p. PMID 11866595.CS1 maint: číselné názvy: seznam autorů (odkaz)
- ^ A b List, B .; Pojarliev, P .; Biller, W. T .; Martin, H. J. (2002). „Prolinem katalyzovaná přímá asymetrická třísložková Mannichova reakce: rozsah, optimalizace a aplikace na vysoce enantioselektivní syntézu 1,2-aminoalkoholů“. Journal of the American Chemical Society. 124 (5): 827–833. doi:10.1021 / ja0174231. PMID 11817958.
- ^ Marques, M. M. B. (2006). "Katalytická enantioselektivní cross-Mannichova reakce aldehydů". Angewandte Chemie International Edition. 45 (3): 348–352. doi:10.1002 / anie.200502630. PMID 16342308.
- ^ List, B .; Pojarliev, P .; Martin, H. J. (2001). "Efektivní prolinem katalyzované Michaelovy přídavky nemodifikovaných ketonů k nitroolefinům". Organické dopisy. 3 (16): 2423–2425. doi:10.1021 / ol015799d. PMID 11483025.
- ^ List, B .; Castello, C. (2001). „Nová třísložková reakce katalyzovaná prolinem ketonů, aldehydů a kyseliny Meldrumové“. Synlett. 2001 (11): 1687. doi:10.1055 / s-2001-18095.
- ^ Zhong, G. (2003). „Facile and Rapid Route to Highly Enantiopure 1,2-Diols by Novel Catalytic Asymmetricα-Aminoxylation of Aldehydes“. Angewandte Chemie International Edition. 42 (35): 4247–4250. doi:10.1002 / anie.200352097. PMID 14502748.
- ^ Brown, S. P .; Brochu, M. P .; Sinz, C. J .; MacMillan, D. W. C. (2003). „Přímá a enantioselektivní organokatalytická α-oxidace aldehydů“ (PDF). Journal of the American Chemical Society. 125 (36): 10808–10809. doi:10.1021 / ja037096s. PMID 12952459.
- ^ A b Brochu, M. P .; Brown, S. P .; MacMillan, D. W. C. (2004). „Přímá a enantioselektivní organokatalytická α-chlorace aldehydů“ (PDF). Journal of the American Chemical Society. 126 (13): 4108–4109. doi:10.1021 / ja049562z. PMID 15053591.
- ^ A b Franzén, J .; Marigo, M .; Fielenbach, D .; Wabnitz, T. C .; Kjaersgaard, K. A .; Jørgensen, K. A. (2005). „Obecný organokatalyzátor pro přímou α-funkcionalizaci aldehydů: stereoselektivní reakce C-C, C-N, C-F, C-Br a C-S Bond-Form. Rozsah a přehled mechanismu“. Journal of the American Chemical Society. 127 (51): 18296–18304. doi:10.1021 / ja056120u. PMID 16366584.
- ^ Cobb, A. J. A .; Shaw, D. M .; Longbottom, D. A .; Gold, J. B .; Ley, S. V. (2005). „Organocatalysis with prolin derivates: Improved katalyzmers for the asymetric Mannich, nitro-Michael and aldol addresses“. Organická a biomolekulární chemie. 3 (1): 84–96. doi:10.1039 / b414742a. PMID 15602602.
- ^ Job, A .; Janeck, C. F .; Bettray, W .; Peters, R .; Enders, D. (2002). "Metodika SAMP- / RAMP-hydrazonu v asymetrické syntéze". Čtyřstěn. 58 (12): 2253. doi:10.1016 / S0040-4020 (02) 00080-7.
- ^ Corey, E. J .; Helal, C. J. (1998). „Redukce karbonylových sloučenin chirálními oxazaborolidinovými katalyzátory: nové paradigma pro enantioselektivní katalýzu a nová výkonná syntetická metoda“. Angewandte Chemie International Edition. 37 (15): 1986. doi:10.1002 / (SICI) 1521-3773 (19980817) 37:15 <1986 :: AID-ANIE1986> 3.0.CO; 2-Z.
- ^ A b Jarvo, E. R .; Miller, S. J. (2002). "Aminokyseliny a peptidy jako asymetrické organokatalyzátory". Čtyřstěn. 58 (13): 2481. doi:10.1016 / S0040-4020 (02) 00122-9.
- ^ Stemmler, R. (2007). „CBS oxazaborolidiny - univerzální katalyzátory pro asymetrickou syntézu“. Synlett. 2007 (6): 0997–0998. doi:10.1055 / s-2007-973876.
- ^ Pidathala, Chandarakala; Hoang, Linh; Vignola, Nicola; List, Benjamin (2003). "Direct Catalytic Asymetric Enolexo Aldolization". Angewandte Chemie International Edition. 42 (24): 2785–2788. doi:10.1002 / anie.200351266. PMID 12820268.
- ^ Mukherjee, Santanu; Yang, Jung; Hoffmann, Sebastian; List, Benjamin (2007). "Asymetrická enaminová katalýza". Chem. Rev. 107 (12): 5471–5569. doi:10.1021 / cr0684016. PMID 18072803.
- ^ García, Ježíš; Oiarbide, Mikel; Palomo, Claudio (15. července 2005). "Aktuální pokrok v asymetrické adiční reakci s aldoly". Chem. Soc. Rev. 33 (2): 65–75. doi:10.1039 / b202901d. PMID 14767502.
- ^ Notz, W; List, B. (2000). „Proline-Catalyzed Direct Asymetric Aldol Reactions“. Journal of the American Chemical Society. 122 (10): 2395. doi:10.1021 / ja994280y.
- ^ García, Ježíš; Oiarbide, Mikel; Palomo, Claudio (15. července 2005). "Aktuální pokrok v asymetrické adiční reakci s aldoly". Chem. Soc. Rev. 33 (2): 65–75. doi:10.1039 / b202901d. PMID 14767502.
- ^ Notz, W; List, B. (2000). „Proline-Catalyzed Direct Asymetric Aldol Reactions“. Journal of the American Chemical Society. 122 (10): 2395. doi:10.1021 / ja994280y.
- ^ Sakthivel, K .; Notz, W; Bui, T; Barbas, C (2000). „Přímé asymetrické aldolové reakce katalyzované aminokyselinami: Bioorganický přístup ke katalytickým asymetrickým reakcím vytvářejícím uhlík – uhlík“. Journal of the American Chemical Society. 122 (22): 5260–5267. doi:10.1021 / ja010037z. PMID 11457388.
- ^ García, Ježíš; Oiarbide, Mikel; Palomo, Claudio (15. července 2005). "Aktuální pokrok v asymetrické adiční reakci s aldoly". Chem. Soc. Rev. 33 (2): 65–75. doi:10.1039 / b202901d. PMID 14767502.
