Robinsonova anulace - Robinson annulation
| Robinsonova anulace | |
|---|---|
| Pojmenoval podle | Robert Robinson |
| Typ reakce | Reakce tvořící prsten |
| Identifikátory | |
| Portál organické chemie | Robinsonova anulace |
| RSC ontologické ID | RXNO: 0000380 |
The Robinsonova anulace je chemická reakce použito v organická chemie pro vytvoření kruhu. Objevil jej Robert Robinson v roce 1935 jako metoda k vytvoření šestičlenného kruhu vytvořením tří nových vazeb uhlík-uhlík.[1] Metoda používá a keton a a methylvinylketon za vzniku α, β-nenasyceného ketonu v a cyklohexan zazvonit a Michael navíc následuje kondenzace aldolu. Tento postup je jednou z klíčových metod pro vytvoření systémů s kondenzovaným kruhem.
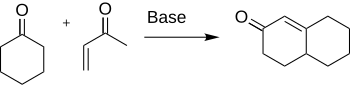
Vznik cyklohexenon a deriváty jsou důležité v chemie pro jejich aplikaci na syntézu mnoha přírodních produktů a dalších zajímavých organických sloučenin, jako je antibiotika a steroidy.[2] Konkrétně syntéza kortizon je dokončena pomocí Robinsonovy anulace.[3]
Počáteční příspěvek k Robinsonově anulaci byl publikován autorem William Rapson a Robert Robinson, zatímco Rapson studoval na Oxfordu u profesora Robinsona. Před jejich prací nebyly cyklohexenonové syntézy odvozeny od α, β-nenasycené ketonové složky. Počáteční přístupy spojily methylvinylketon s a naftol za získání naftoloxidu, ale tento postup nebyl dostatečný k vytvoření požadovaného cyklohexenonu. To bylo připisováno nevhodným podmínkám reakce.[1]
Robinson a Rapson v roce 1935 zjistili, že interakce mezi cyklohexanonem a α, β-nenasyceným ketonem poskytla požadovaný cyklohexenon. Zůstává jednou z klíčových metod konstrukce šestičlenných kruhových sloučenin. Vzhledem k tomu, že je tak široce používán, bylo zkoumáno mnoho aspektů reakce, jako jsou variace substrátů a reakční podmínky, jak jsou popsány v části o rozsahu a variaci.[4] Robert Robinson získal Nobelovu cenu za chemii v roce 1947 za příspěvek ke studiu alkaloidů.[5]
Reakční mechanismus
Původní postup Robinsonovy anulace začíná nukleofilní útok ketonu v a Michaelova reakce na vinylketonu za vzniku meziproduktu Michaelova aduktu. Následné uzavření kruhu typu aldol vede k ketoalkoholu, který je poté následován dehydratací za vzniku anulačního produktu.
V reakci Michaela byla keton je deprotonován bází za vzniku izolovat nukleofil, který útočí na akceptor elektronů (červeně). Tímto akceptorem je obecně a, p-nenasycený keton aldehydy, deriváty kyselin a podobné sloučeniny mohou také fungovat (viz rozsah). V zde zobrazeném příkladu je regioselektivita diktována tvorbou termodynamického enolátu. Alternativně je regioselektivita často řízena použitím p-diketonu nebo p-ketoesteru jako enolátové složky, protože je silně preferována deprotonace na uhlíku ohraničeném karbonylovými skupinami. Intramolekulární kondenzace aldolu pak probíhá takovým způsobem, že se nainstaluje šestičlenný kruh. V konečném produktu tvoří tři atomy uhlíku α, β-nenasycený systém a uhlík α k jeho karbonylové skupině čtyřuhlíkový můstek nově instalovaného kruhu.

Aby se zabránilo reakci mezi originálem izolovat a cyklohexenon Produkt, původní Michaelův adukt je často nejprve izolován a poté cyklizován, čímž se získá požadovaný oktalon v samostatném kroku.[6]
Stereochemie
Byly dokončeny studie o formování hydroxy ketony v Robinsonově anulačním reakčním schématu. Trans sloučenina je upřednostňována kvůli antiperiplanárním účinkům konečné aldolové kondenzace v kineticky řízených reakcích. Bylo však také zjištěno, že cyklizace může probíhat v synklinální orientaci. Na obrázku níže jsou uvedeny tři možné stereochemické dráhy, za předpokladu stavu přechodu židle.[7]

Předpokládá se, že rozdíl ve tvorbě těchto přechodových stavů a jejich odpovídajících produktů je způsoben interakcemi rozpouštědel. Scanio zjistil, že změna rozpouštědla reakce z dioxanu na DMSO poskytuje ve výše uvedeném kroku D jinou stereochemii. To naznačuje, že přítomnost protických nebo aprotických rozpouštědel vede k různým přechodovým stavům.[8]
Mechanická klasifikace
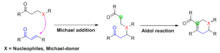
Robinsonova anulace je pozoruhodným příkladem širší třídy chemických transformací nazývaných Tandem Michael-Aldolovy reakce, které postupně kombinují Michael navíc a aldolová reakce do jediné reakce. Jako je tomu v případě Robinsonovy anulace, Michaelova adice obvykle nastává nejprve, aby se obě reaktanty spojily dohromady, poté aldolová reakce probíhá intramolekulárně za vzniku kruhového systému v produktu. Obvykle se generují pětičlenné nebo šestičlenné kruhy.
Rozsah a variace
Reakční podmínky
Ačkoli se Robinsonova anulace obecně provádí za základních podmínek, reakce se provádějí za různých podmínek. Heathcock a Ellis uvádějí podobné výsledky jako metoda bazicky katalyzovaná kyselina sírová.[2] Michaelova reakce může nastat za neutrálních podmínek prostřednictvím enamin. A Mannichova základna může být zahříván v přítomnosti ketonu za vzniku Michaelova aduktu.[6] Byla popsána úspěšná příprava sloučenin pomocí Robinsonových anulačních metod.[9]
Michaelův akceptor
Typický Michael akceptor je α, β-nenasycený keton aldehydy a deriváty kyselin také fungují. Kromě toho Bergmann et al. uvádí, že dárci jako nitrily, nitrosloučeniny, sulfony a jisté uhlovodíky lze použít jako akceptory.[10] Celkově jsou Michaelovy akceptory obecně aktivované olefiny, jako jsou ty, které jsou uvedeny níže, kde EWG označuje skupinu přitahující elektrony, jako je kyano, keto nebo ester, jak je uvedeno.
Wichterlova reakce
Wichterlova reakce je variantou Robinsonovy anulace, která nahrazuje methylvinylketon s 1,3-dichlor-cis-2-buten. To dává příklad použití jiného Michael akceptor z typického α, β-nenasyceného ketonu. 1,3-dichlor-cisK zabránění nežádoucí polymerace nebo kondenzace během Michaelova přídavku se používá -2-buten.[11]

Hauserova anulace
Sekvence reakce v související Hauserově anulaci je a Michael navíc následuje a Dieckmannova kondenzace a nakonec eliminace. Dieckmannova kondenzace je podobné uzavírání prstence intramolekulární chemická reakce diesterů s bází za vzniku β-ketoesterů. Hauserovým donorem je aromatický sulfon nebo methylensulfoxid s karboxylovou esterovou skupinou v orto poloze. Akceptor společnosti Hauser je Michael akceptor. V původní Hauserově publikaci reaguje ethyl-2-karboxybenzylfenylsulfoxid s pent-3-en-2-onem s LDA jako bází v THF při -78 ° C.[12]

Asymetrická Robinsonova anulace
Asymetrická syntéza produktů Robinsonovy anulace nejčastěji zahrnuje použití a prolin katalyzátor. Studie uvádějí použití L-prolinu i několika dalších chirální aminy pro použití jako katalyzátory během obou kroků Robinsonovy anulační reakce.[13] Výhodou použití opticky aktivní prolinové katalýzy je, že jsou stereoselektivní enantiomerní excesy 60–70%.[14]
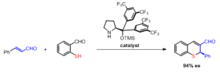
Wang a kol. popsali syntézu chirálních thiochromenů v jedné nádobě takovou organokatalytickou Robinsonovou anulací.[15]
Aplikace pro syntézu
The Wieland – Miescher keton je Robinsonův anulační produkt 2-methyl-cyklohexan-1,3-dionu a methylvinylketonu. Tato sloučenina se používá při syntéze mnoha steroidy které mají důležité biologické vlastnosti a lze je vyrobit enantiočistě pomocí prolinové katalýzy.[14]
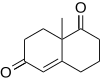
F. Dean Toste a spolupracovníci[16] použili Robinsonovu anulaci v celkové syntéze tetracyklického (+) - fawcettiminu Lycopodium alkaloid, který má potenciální použití k inhibici acetylcholinesteráza.
Enantioselektivní cesta k platensimycinu
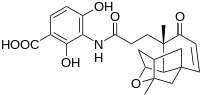
Vědci ve společnosti Merck nedávno objevili novou antibiotickou sloučeninu olova s potenciálními léčivými aplikacemi platensimycin jak je vidět na sousedním obrázku.
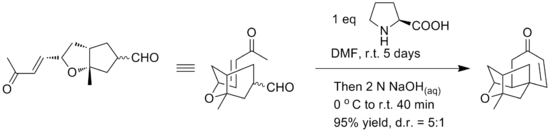
Počáteční syntéza poskytla racemickou formu sloučeniny pomocí intramolekulární etherifikační reakce alkoholových motivů a dvojné vazby. Yamamoto uvádí použití alternativní intramolekulární Robinsonovy anulace k zajištění přímé enantioselektivní syntézy tetracyklického jádra platensimycinu. Uvádí se, že klíčový krok Robinsonovy anulace byl proveden v jednom hrnci pomocí L-prolin pro chirální kontrolu. Reakční podmínky jsou uvedeny níže.[17]
Reference
- ^ A b Rapson, William Sage; Robinson, Robert (1935). "307. Pokusy o syntézu látek souvisejících se steroly. Část II. Nová obecná metoda pro syntézu substituovaných cyklohexenonů". Journal of the Chemical Society (obnoveno): 1285. doi:10.1039 / JR9350001285.
- ^ A b Heathcock, Clayton H .; Ellis, John E .; McMurry, John E .; Coppolino, Anthony (1971). "Kyselinou katalyzovaný Robinson Annelations". Čtyřstěn dopisy. 12 (52): 4995–96. doi:10.1016 / s0040-4039 (01) 97609-9.
- ^ Acheson, R. M .; Robinson, Robert (1952). "198. Experimenty se syntézou kortizonu. Část I. Některé deriváty cyklopentenonu". Journal of the Chemical Society (obnoveno): 1127. doi:10.1039 / JR9520001127.
- ^ Ho, Tse-Lok (1992). Tandemové organické reakce. New York: Wiley. ISBN 978-0-471-57022-6.
- ^ McMurry, John (2008). Organická chemie (7. vydání). Belmont, Kalifornie: Thomson Brooks / Cole. ISBN 978-0-495-11258-7.
- ^ A b Gawley, Robert E. (1976). „Robinsonova anulace a související reakce“. Syntéza. 1976 (12): 777–794. doi:10.1055 / s-1976-24200.
- ^ Nussbaumer, Cornelius (1990). „Stereochemistry of the Robinson Anellation: Studies on the Mode of Formation of the Intermediate Hydroxy Ketones“. Helvetica Chimica Acta. 73 (6): 1621–1636. doi:10,1002 / hlca.19900730607.
- ^ Scanio, Charles J. V .; Starrett, Richmond M. (1971). „Pozoruhodně stereoselektivní Robinsonova anulační reakce“. Journal of the American Chemical Society. 93 (6): 1539–1540. doi:10.1021 / ja00735a059.
- ^ Buchschacher, Paul; A. Fürst; J. Gutzwiller (1985). „(S) -8a-methyl-3,4,8,8a-tetrahydro-1,6 (2H, 7H) - naftalendion" (PDF). Organické syntézy. 63: 37. doi:10.15227 / orgsyn.063.0037. Archivovány od originál (PDF) dne 24. dubna 2012.
- ^ Adams, Roger (1959). Organické reakce. New York: John Wiley & Sons, Inc., str. 179–555. ISBN 978-0471007593.
- ^ Wang, Zerong (2009). „Wichterlova reakce“. Komplexní organické názvové reakce a činidla. Hoboken, N.J .: John Wiley. doi:10.1002 / 9780470638859.conrr669. ISBN 978-0-470-63885-9.
- ^ Hauser, Frank M .; Rhee, Richard P. (1978). „Nové syntetické metody pro regioselektivní analýzu aromatických kruhů: 1-hydroxy-2,3-disubstituované naftaleny a 1,4-dihydroxy-2,3-disubstituované naftaleny.“ The Journal of Organic Chemistry. 43 (1): 178–180. doi:10.1021 / jo00395a048.
- ^ Eder, Ulrich; Sauer, Gerhard; Wiechert, Rudolf (1971). "Nový typ asymetrické cyklizace na opticky aktivní steroidní částečné struktury CD". Angewandte Chemie International Edition v angličtině. 10 (7): 496–497. doi:10.1002 / anie.197104961.
- ^ A b Bui, Tommy; Barbas, Carlos F (2000). "Prolinem katalyzovaná asymetrická Robinsonova anulační reakce". Čtyřstěn dopisy. 41 (36): 6951–6954. doi:10.1016 / s0040-4039 (00) 01180-1.
- ^ Wang, W .; Li, H .; Wang, J .; Zu, L., J. Am. Chem. Soc. 2006; 128, 10354.
- ^ Linghu, X .; Kenedy-Smith, J. J .; Toste, F. D. (2007). "Celková syntéza (+) - Fawcettiminu". Angew. Chem. Int. Vyd. 46 (40): 7671–3. doi:10.1002 / anie.200702695. PMID 17729226.
- ^ Li, Pingfan; Payette, Joshua N .; Yamamoto, Hisashi (2007). „Enantioselektivní cesta k platensimycinu: přístup intramolekulární Robinsonovy anulace“. Journal of the American Chemical Society. 129 (31): 9534–9535. doi:10.1021 / ja073547n. PMC 2553032. PMID 17630748.
