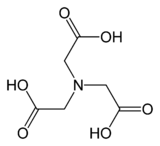
Kyselina nitrilotrioctová - Nitrilotriacetic acid
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC 2,2 ', 2' '- kyselina nitrilotrioctová[3] | |
| Ostatní jména | |
| Identifikátory | |
3D model (JSmol ) | |
| 1710776 | |
| ChEBI | |
| ChemSpider | |
| DrugBank | |
| Informační karta ECHA | 100.004.869 |
| Číslo ES |
|
| 3726 | |
| KEGG | |
| Pletivo | Nitrilotriacetát + kyselina |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 2811 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6H9NÓ6 | |
| Molární hmotnost | 191.14 [4] |
| Vzhled | Bílé krystaly |
| Bod tání | 246[4] ° C (475 ° F; 519 K) |
| Nerozpustný. <0,01 g / 100 ml při 23 ° C [4] | |
| Termochemie | |
Std entalpie of formace (ΔFH⦵298) | −1,3130– −1,3108 MJ mol−1 |
| Nebezpečí | |
| Piktogramy GHS |   |
| Signální slovo GHS | Varování |
| H302, H319, H351 | |
| P281, P305 + 351 + 338 | |
| Bod vzplanutí | 100 ° C (212 ° F; 373 K) |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 1,1 g kg−1 (orální, krysa) |
| Související sloučeniny | |
Související alkanové kyseliny | |
Související sloučeniny | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Kyselina nitrilotrioctová (NTA) je aminopolykarboxylová kyselina se vzorcem N (CH2CO2H)3. Je to bezbarvá pevná látka, která se používá jako chelatační činidlo, který tvoří koordinační sloučeniny s kovovými ionty (cheláty), jako je Ca2+Co2+ , Cu2+a Fe3+.[5]
Výroba a použití
Kyselina nitrilotrioctová je komerčně dostupná jako volná kyselina a jako sodná sůl. Vyrábí se z amoniak, formaldehyd, a kyanid sodný nebo kyanovodík. Celosvětová kapacita se odhaduje na 100 tisíc tun ročně.[6] NTA se také kogeneruje jako nečistota při syntéze EDTA, vznikající reakcí vedlejšího produktu amoniaku.[7]
Koordinační chemie a aplikace
NTA je stativ tetradentát trianiontový ligand.[8]
Použití NTA je podobné použití EDTA, obě jsou chelatačními činidly. Používá se pro změkčování vody a jako náhrada za sodík a draslík trifosfát v pracích a čisticích prostředcích.
V jedné aplikaci odstraňuje NTA jako chelatační činidlo Cr, Cu a As ze dřeva, které bylo ošetřeno chromátovaný arzeničnan měďnatý.[9]
Laboratorní použití
V laboratoři se tato sloučenina používá při komplexometrických titracích. Varianta NTA se používá pro izolaci a čištění proteinů v Jeho značka metoda.[10] Upravená NTA se používá k imobilizaci nikl na pevné podložce. To umožňuje čištění proteinů obsahujících značku skládající se ze šesti histidinových zbytků na obou koncích.[11]
Jeho značka váže kov na kov chelátor komplexy. Dříve, kyselina iminodioctová byl použit k tomuto účelu. Nyní se běžněji používá kyselina nitrilotrioctová.[12]
Pro laboratorní použití Ernst Hochuli et al. 1987 navázal ligand NTA a ionty niklu na agaróza korálky.[13] Tento Ni-NTA agaróza je nejpoužívanějším nástrojem k čištění jeho označených proteinů pomocí afinitní chromatografie.
- NTA komplexy

Tři pohledy na strukturu [Ni (NTA) (H2Ó)2]−.
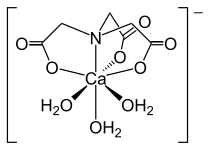
Struktura nitrilotriacetátového aniontu [Ca (NTA) (H2Ó)3]−.
Toxicita a životní prostředí
Kyselina nitriloctová může způsobit podráždění očí, kůže a dýchacích cest; a může způsobit poškození ledvin a močového měchýře. Předpokládá se, že sloučenina může způsobit rakovinu člověka.[1]
Na rozdíl od EDTA je NTA snadno biologicky odbouratelný a během čištění odpadních vod je téměř úplně odstraněn.[6] Dopady NTA na životní prostředí jsou minimální. Navzdory širokému použití v čisticích prostředcích je koncentrace v dodávce vody příliš nízká, aby měla značný dopad na lidské zdraví nebo kvalitu životního prostředí.[14]
Reference
- ^ A b "Kyselina nitrilotrioctová - shrnutí sloučeniny". PubChem Compound. USA: Národní centrum pro biotechnologické informace. 26. března 2005. Identifikace. Citováno 13. července 2012.
- ^ Kyselina nitrilotrioctová
- ^ Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. str. 21, 679. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
- ^ A b C ChemBK Chemická databáze http://www.chembk.com/en/chem/Nitrilotriacetic%20acid
- ^ Kyselina nitrilotrioctová a její soli, Mezinárodní agentura pro výzkum rakoviny
- ^ A b Charalampos Gousetis, Hans-Joachim Opgenorth. "Kyselina nitrilotrioctová". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a17_377.
- ^ Hart, J. Roger (2005) „Ethylenediaminetetraoctová kyselina a související chelatační činidla“ v Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a10_095
- ^ B. L. Barnett, V. A. Uchtman "Strukturní zkoumání molekul vázajících vápník. 4. Vazba vápníku na aminokarboxyláty. Krystalové struktury Ca (CaEDTA) .7H20 a Na (CaNTA)" Inorg. Chem., 1979, svazek 18, str. 2674–2678. doi:10.1021 / ic50200a007
- ^ Fang-Chih, C .; Ya-Nang, W .; Pin-Jui, C .; Chun-Han, K. Faktory ovlivňující chelatační extrakci Cr, Cu a As ze dřeva ošetřeného CCA. J. Environ. Manag. 2013, 122.
- ^ Liu, Weijing (2016). „Depozice vrstva po vrstvě s polymery obsahujícími nitrilotriacetát, pohodlný způsob výroby fólií vázajících kovy a proteiny“. ACS Applied Materials & Interfaces. 8 (16): 10164–73. doi:10.1021 / acsami.6b00896. PMID 27042860.
- ^ qiaexpresionista
- ^ Lauer, Sabine A .; Nolan, John P. (2002). "Vývoj a charakterizace mikrosfér nesoucích Ni-NTA". Cytometrie. 48 (3): 136–145. doi:10,1002 / cyto.10124. ISSN 1097-0320. PMID 12116359.
- ^ Hochuli, E .; Döbeli, H .; Schacher, A. (leden 1987). "Nový kovový chelátový adsorbent selektivní pro proteiny a peptidy obsahující sousední histidinové zbytky". Journal of Chromatography A. 411: 177–184. doi:10.1016 / s0021-9673 (00) 93969-4. ISSN 0021-9673. PMID 3443622.
- ^ Brouwer, N .; Terpstra, P. Ekologické a toxikologické vlastnosti kyseliny nitrilotrioctové (NTA) jako čisticího prostředku. Tenside Surfactants Detergents 1995, 32, 225-228.


