Koenigs – Knorr reakce - Koenigs–Knorr reaction
The Koenigs – Knorr reakce v organická chemie je substituční reakce a glykosyl halogenid s alkohol dát a glykosid. Je to jedna z nejstarších glykosylačních reakcí. Je pojmenován po Wilhelm Koenigs (1851–1906), student von Bayer a spolužák s Hermann Emil Fischer a Edward Knorr, student Koenigse.

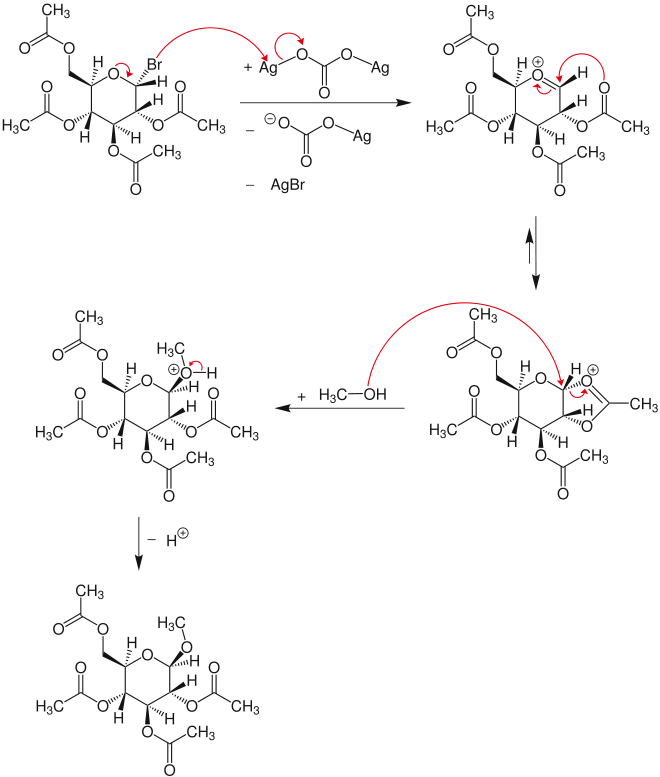
V původní podobě léčili Koenigs a Knorr acetobromoglukóza s alkoholy za přítomnosti uhličitan stříbrný.[1] Krátce nato Fischer a Armstrong hlásili velmi podobná zjištění.[2]
Ve výše uvedeném příkladu je stereochemický výsledek určen přítomností sousední skupiny na C2, která půjčuje kotevní pomoc, což má za následek vytvoření 1,2-trans stereochemického uspořádání. Estery (např. acetyl, benzoyl, pivalyl ) obecně poskytují dobrou kotvicí pomoc, zatímco ethery (např. benzyl, methyl atd.) ne, což vede ke směsi stereoizomery.
Mechanismus
V prvním kroku mechanismus, glykosylbromid reaguje s uhličitan stříbrný po vyloučení bromid stříbrný a anion uhličitanu stříbrného na oxokarbeniový ion. Z této struktury se vytvoří dioxolaniumnium, které je napadeno methanolem přes SN2 mechanismus na karbonylovém atomu uhlíku. Tento útok vede k inverzi. Po deprotonaci meziproduktu oxonia se vytvoří produktový glykosid.[3]
Reakci lze také aplikovat na uhlohydráty s dalšími chránícími skupinami. Při syntéze oligosacharidů místo methanolu se používají jiné sacharidy, které byly modifikovány ochrannými skupinami tak, že je přístupná pouze jedna hydroxylová skupina.
Dějiny
Metoda byla později přenesena Emilem Fischerem a Burckhardtem Helferichem na jiné chlorem substituované puriny a byla tak vyrobena poprvé syntetické nukleosidy. To bylo později vylepšeno a upraveno mnoha chemiky.
Alternativní reakce
Obecně se Koenigs-Knorrova reakce týká použití glykosylchloridů, bromidů a nověji jodidů jako donorů glykosylu. Koenigs-Knorrovu reakci lze provést s alternativními promotory, jako jsou různé soli těžkých kovů bromid rtuťnatý /oxid rtuťnatý, kyanid rtuťnatý a stříbrný triflát.[4][5] Pokud se použijí soli rtuti, reakce se obvykle nazývá Helferichova metoda Další metody glykosidace jsou Fischerova glykosidace, Použití glykosylacetáty, thioglykosidy, glykosyl trichloracetimidáty, glykosylfluoridy nebo n-pentenyl glykosidy tak jako dárci glykosylu nebo intramolekulární dodání aglykonu.
Reference
- ^ Wilhelm Koenigs a Edward Knorr (1901). „Ueber einige Derivate des Traubenzuckers und der Galactose (p)“. Berichte der deutschen chemischen Gesellschaft. 34 (1): 957–981. doi:10,1002 / cber.190103401162.
- ^ Hermann Emil Fischer, Armstrong, E.F. (1901). „Ueber die isomeren Acetohalogen-Derivate des Traubenzuckers und die Synthese der Glucoside“. Berichte der deutschen chemischen Gesellschaft. 34 (2): 2885–2900. doi:10,1002 / cber.190103402251.CS1 maint: více jmen: seznam autorů (odkaz)Fischer, E. a Armstrong, E.F. (1901) Ber. Dtsch. Chem. Ges., 34, 2885
- ^ László Kürti und Barbara Czakó .: Strategické aplikace pojmenovaných reakcí v organické syntéze: pozadí a podrobné mechanismy, Elsevier Academic Press, 2005, strana 246-247, ISBN 978-0-12-429785-2.
- ^ Helferich, B. a Zirner, J. (1962) Chem. Ber., 95, 2604
- ^ Hanessian, S. a Banoub, J. (1980) Metody Carbohydr. Chem., 8, 247