Hiyama spojka - Hiyama coupling - Wikipedia
| Hiyama spojka | |
|---|---|
| Pojmenoval podle | Tamejiro Hiyama |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | hiyama-spojka |
| RSC ontologické ID | RXNO: 0000193 |
The Hiyama spojka je palladium -katalyzovaný křížová vazebná reakce z organosilany s organické halogenidy použito v organická chemie tvořit vazby uhlík-uhlík (C-C vazby). Tuto reakci objevil v roce 1988 Tamejiro Hiyama a Yasuo Hatanaka jako metoda syntetického vytváření vazeb uhlík-uhlík chemoterapie - a regioselektivita.[1] Hiyama vazba byla použita pro syntézu různých přírodní produkty.[2]
- : aryl, alkenyl nebo alkinyl
- : aryl, alkenyl, alkinyl nebo alkyl
- : Cl, F nebo alkyl
- : Cl, Br, I nebo OTf
Historie reakcí
Spojka Hiyama byla vyvinuta pro boj s problémy spojenými s jinými organokovový činidla. Počáteční reaktivita organokřemíku nebyla ve skutečnosti poprvé hlášena Hiyamou, protože Kumada ohlásil kopulační reakci s použitím organofluorosilikátů[3] je uvedeno níže. Hiyama poté zjistil, že organosilany mají reaktivitu, když jsou aktivovány zdrojem fluoridu.[4][5] Tato reaktivita v kombinaci se solí palladia vytváří vazbu uhlík-uhlík s elektrofilním uhlíkem, jako je organický halogenid. Ve srovnání s inherentními problémy dobře používaných organokovových činidel, jako je organomagnesium (Grignardovy reagencie ) a organokopír činidla, která jsou velmi reaktivní a je o nich známo, že mají nízkou chemoselektivitu, natolik, aby zničila funkční skupiny na obou vazebných partnerech, jsou organokřemičité sloučeniny neaktivní. Další organokovová činidla používající kovy, jako např zinek, cín, a bór, snížit problém s reaktivitou, ale mají další problémy spojené s každým činidlem. Organozinek činidla jsou citlivá na vlhkost, organický cín sloučeniny jsou toxické a organoboron činidla nejsou snadno dostupná, jsou drahá a často nejsou stabilní. Organosilany jsou snadno dostupné sloučeniny, které po aktivaci (podobně jako sloučeniny organotinu nebo organoboru) z fluoridu nebo báze mohou reagovat s organohalidy za vzniku C-C vazeb chemo- a regioselektivním způsobem. Reakce, která byla poprvé uvedena, byla použita ke spojení snadno vyrobeného (a aktivovaného) organokřemíku nukleofily a organohalogenidy (elektrofily ) v přítomnosti palladiového katalyzátoru.[1] Od tohoto objevu byly různé skupiny prováděny s cílem rozšířit rozsah této reakce a „opravit“ problémy s touto první kopulací, jako je potřeba aktivace organosilanu fluoridem.

Mechanismus
Organosilan je aktivován pomocí fluorid (jako nějaký druh soli jako např TBAF nebo ÚLOHA ) nebo základna pro vytvoření a pětimocný křemíkové centrum, které je labilní natolik, aby bylo možné rozbít vazbu C-Si během transmetalačního kroku.[6] Obecné schéma pro vytvoření tohoto klíčového meziproduktu je uvedeno níže. K tomuto kroku dochází in situ nebo současně s katalytickým cyklem v reakci.

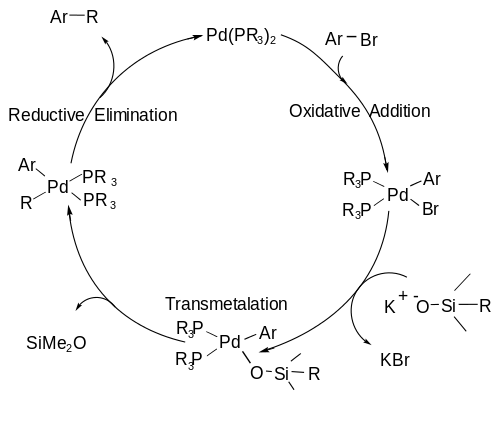
Mechanismus spojky Hiyama sleduje katalytický cyklus, včetně A) oxidační přísada krok, ve kterém organický halogenid přidává k palladiu oxidující kov z palladia (0) na palladium (II); a B) transmetalace krok, ve kterém je vazba C-Si přerušena a druhý uhlíkový fragment je vázán na centrum palladia; a nakonec C) a redukční eliminace krok, ve kterém se vytvoří vazba C-C a palladium se vrátí do stavu nulové valence, aby znovu zahájil cyklus.[7] The katalytický cyklus je zobrazen níže.

Rozsah a omezení
Rozsah
Hiyamovu spojku lze použít na tvorbu Csp2-Csp2 (např. aryl –Aryl) vazby stejně jako Csp2-Csp3 (např. aryl -alkyl ) vazby. Dobré syntetické výtěžky jsou dosaženy spojkami arylhalogenidy, vinylhalogenidy, a allylický halogenidy a organo jodidy poskytnout nejlepší výnosy. Rozsah této reakce byl rozšířen o uzavření středních kruhů pomocí Scott E. Dánsko.[8]

Rovněž bylo provedeno spojení alkylhalogenidů s organo-halosilany jako alternativními organosilany. Organochlorsilany umožňují kondenzaci s arylchloridy, které jsou hojné a obecně ekonomičtější než aryljodidy.[9] Niklový katalyzátor umožňuje přístup k nové reaktivitě organotrifluorosilanů, jak uvádí GC Fu et al.[10] Sekundární alkylhalogenidy jsou spojeny s arylsilany[11] s dobrými výtěžky pomocí této reakce.

Omezení
Hiyamova vazba je omezena potřebou fluoridu za účelem aktivace organokřemičitého činidla. Přidání fluoridu štěpí všechny skupiny chránící křemík (např. silyl ethery[12]), které se často používají v organické syntéze. Fluoridový iont je také zásaditý, takže přídavkem tohoto aktivátoru mohou být ovlivněny chránící skupiny citlivé na bázi, kyselé protony a funkční skupiny. Většina aktivního výzkumu týkajícího se této reakce zahrnuje obcházení tohoto problému. K překonání tohoto problému mnoho skupin zkoumalo použití dalších základních aditiv pro aktivaci nebo použití jiného organosilanového činidla dohromady, což vedlo k mnohonásobným variacím původní Hiyamaho vazby.
Variace
Jedna modifikace Hiyamovy vazby využívá silacyklobutanový kruh a zdroj fluoridu, který je hydratován, jak je uvedeno níže.[13] To napodobuje použití alkoxysilanu / organosilanolu spíše než použití alkylsilanu. Mechanismus této reakce pomocí zdroje fluoridu umožňoval návrh budoucích reakcí, které by se mohly vyhnout použití zdroje fluoridu.

Spojky Hiyama bez fluoru
Bylo vyvinuto mnoho modifikací Hiyama vazby, které zabraňují použití fluoridového aktivátoru / báze. Pomocí organochlorosilanů našel Hiyama spojovací schéma využívající NaOH jako základní aktivátor.[14] Byly hlášeny úpravy používající alkoxysilany s použitím mírnějších bází, jako je NaOH [15] a dokonce i voda.[16] Studium těchto mechanismů vedlo k vývoji propojení Hiyama - Dánsko, které využívá organosilanoly jako spojovací partneři.

Další třída spojek Hiyama bez fluoridů zahrnuje použití a Lewisova kyselina aditivum, které umožňuje báze jako K.3PO4[17] být použit, nebo aby reakce probíhala bez zásadité přísady.[18][19] Přidání a měď Bylo rovněž popsáno, že kokatalyzátor umožňuje použití mírnějšího aktivačního činidla[17] a bylo dokonce prokázáno, že dostává obrat ve kterém je obrat palladia (II) i mědi (I) v katalytickém cyklu spíše než přidání stechiometrický Lewisova kyselina (např. Stříbro (I),[18] měď (I)[19]).

Spojka Hiyama – Dánsko
| Hiyama – Dánsko | |
|---|---|
| Pojmenoval podle | Tamejiro Hiyama Scott E. Dánsko |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | hiyama-denamrk-spojka |
The Hiyama – Dánsko je modifikace Hiyamovy kopulace, která nevyžaduje fluoridové aditivum k využití organosilanolů a organických halogenidů jako vazebných partnerů. Obecné reakční schéma je uvedeno níže, což ukazuje využití a Brønsted základna jako aktivační činidlo na rozdíl od fluoridu, fosfinové ligandy jsou také použity na kovovém středu.[2]

Specifický příklad této reakce je uveden u činidel. Pokud by byl použit fluorid, jako v původním protokolu Hiyama, pak tert-butyldimethylsilyl (TBS) ether pravděpodobně by byl zničen.[20]

Spojovací mechanismus Hiyama – Dánsko
Zkoumání mechanismu této reakce naznačuje, že k aktivaci přidání organosilanu do centra palladia je zapotřebí pouze tvorba silonátu. Přítomnost pětimocného křemíku není nutná a kinetický analýza ukázala, že tato reakce má závislost prvního řádu na koncentraci silonátu.[2] To je způsobeno vytvářením klíčové vazby, vazbou Pd-O během transmetalačního kroku, která pak umožňuje přenos uhlíkového fragmentu do středu palladia. Na základě tohoto pozorování se zdá, že krokem omezujícím rychlost v tomto katalytickém cyklu je tvorba vazby Pd-O, ve které zvýšené koncentrace silonátu zvyšují rychlost této reakce (což svědčí o rychlejších reakcích).

Viz také
- Heck reakce
- Spojka Kumada
- Spojka Negishi
- Sonogashira spojka
- Stilleho reakce
- Suzukiho reakce
- Palladiem katalyzované kopulační reakce
externí odkazy
Reference
- ^ A b Hatanaka, Y .; Hiyama, T. (1988). „Křížová vazba organosilanů s organickými halogenidy zprostředkovaná palladiovým katalyzátorem a tris (diethylamino) sulfonium difluorotrimethylsilikátem“. Journal of Organic Chemistry. 53 (4): 918–920. doi:10.1021 / jo00239a056.
- ^ A b C Denmark, S.E .; Regens, C. S. (2008). „Křížové vazebné reakce organosilanolů a jejich solí katalyzované palladiem: praktické alternativy k metodám založeným na boru a cínu“. Účty chemického výzkumu. 41 (11): 1486–1499. doi:10.1021 / ar800037p. PMC 2648401. PMID 18681465.
- ^ A b Yoshida, J .; Tamao, K .; Yamamoto, H .; Kakui, T .; Uchida, T .; Kumada, M. (1982), "Organofluorosilikáty v organické syntéze. 14. Tvorba vazby uhlík-uhlík podporovaná solemi palladia", Organometallics, 1 (3): 542–549, doi:10.1021 / om00063a025
- ^ Hiyama, T .; Obayashi, M .; Mori, I .; Nozaki, H. (1983), „Generování silylových aniontů bez kovů z disilanů a fluoridového katalyzátoru. Syntetické reakce s aldehydy a 1,3-dieny“, The Journal of Organic Chemistry, 48 (6): 912–914, doi:10.1021 / jo00154a043
- ^ Fujita, M .; Hiyama, T. (1988), „Erythro-direktivní redukce a-substituovaných alkanonů pomocí hydrosilanů v kyselém prostředí“, The Journal of Organic Chemistry, 53 (23): 5415–5421, doi:10.1021 / jo00258a004
- ^ Hiyama, T. (2002), „Jak jsem narazil na křemíkovou křížovou vazebnou reakci“, Journal of Organometallic Chemistry, 653 (1–2): 58–61, doi:10.1016 / s0022-328x (02) 01157-9
- ^ Miyaura, N .; Suzuki, A. (1995), „Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds“, Chemické recenze, 95 (7): 2457–2483, CiteSeerX 10.1.1.735.7660, doi:10.1021 / cr00039a007
- ^ A b Denmark, S.E .; Yang, S.-M. (2002), "Intramolekulární křemíkové křížové vazebné reakce: Obecná syntéza prstenů střední velikosti obsahujících 1,3-cis-cis dienovou jednotku", Journal of the American Chemical Society, 124 (10): 2102–2103, doi:10.1021 / ja0178158, PMID 11878949
- ^ Gouda, K.-i .; Hagiwara, E .; Hatanaka, Y .; Hiyama, T. (1996), „Cross-Coupling Reactions of Aryl Chlorides with Organochlorosilanes: Highly Effect Methods for Arylation or Alkenylation of Aryl Chlorides“, The Journal of Organic Chemistry, 61 (21): 7232–7233, doi:10.1021 / jo9611172, PMID 11667637
- ^ Powell, D. A .; Fu, G. C. (2004), „Niklové katalyzované křížové vazby organokřemičitých činidel s neaktivními sekundárními alkylbromidy“, Journal of the American Chemical Society, 126 (25): 7788–7789, doi:10.1021 / ja047433c, PMID 15212521
- ^ Strotman, N. A .; Sommer, S .; Fu, G. C. (2007), „Hiyama Reakce aktivovaných a neaktivovaných sekundárních alkylhalogenidů katalyzovaných komplexem nikl / norefedrin“, Angewandte Chemie International Edition, 46 (19): 3556–3558, doi:10.1002 / anie.200700440, PMID 17444579
- ^ Greene, T. W .; Wuts, P. G. M. Ochranné skupiny v organické syntéze, 3. vydání .; John Wiley & Sons: New York, 1991. ISBN 0471160199
- ^ A b Denmark, S.E .; Wehrli, D .; Choi, J. Y. (2000), „Konvergence mechanických cest v palladiu (0) - katalyzovaná křížová vazba alkenylsilacyklobutanů a alkenylsilanolů“, Organické dopisy, 2 (16): 2491–2494, doi:10.1021 / ol006170y, PMID 10956529
- ^ A b Hagiwara, E .; Gouda, K.-i .; Hatanaka, Y .; Hiyama, T. (1997), „NaOH podporované křížové vazebné reakce organokřemičitých sloučenin s organickými halogenidy: praktické cesty k biarylům, alkenylarenům a konjugovaným dienům“, Čtyřstěn dopisy, 38 (3): 439–442, doi:10.1016 / s0040-4039 (96) 02320-9
- ^ Shi, S .; Zhang, Y. (2007), „Pd (OAc) 2-katalyzované křížové vazebné reakce arylsiloxanů bez aluoridů s arylbromidy ve vodném prostředí“, The Journal of Organic Chemistry, 72 (15): 5927–5930, doi:10.1021 / jo070855v, PMID 17585827
- ^ Wolf, C .; Lerebours, R. (2004), „Křížové vazebné reakce arylsiloxanů s arylchloridy a bromidy ve vodě na katalyzované kyselinou fosforitou na NaOH“, Organické dopisy, 6 (7): 1147–1150, doi:10.1021 / ol049851s, PMID 15040744
- ^ A b C Nakao, Y .; Takeda, M .; Matsumoto, T .; Hiyama, T. (2010), „Cross-Coupling Reactions through the Intramolecular Activation of Alkyl (triorgano) silanes“, Angewandte Chemie, 122 (26): 4549–4552, doi:10,1002 / ange.201000816
- ^ A b Hirabayashi, K .; Mori, A .; Kawashima, J .; Suguro, M .; Nishihara, Y .; Hiyama, T. (2000), „Palladium-Catalyzed Cross-Coupling of Silanols, Silanediols, and Silanetriols Promated by Silver (I) Oxide“, The Journal of Organic Chemistry, 65 (17): 5342–5349, doi:10.1021 / jo000679p, PMID 10993364
- ^ A b Nishihara, Y .; Ikegashira, K .; Hirabayashi, K .; Ando, J.-i .; Mori, A .; Hiyama, T. (2000), „Coupling Reactions of Alkynylsilanes Mediated by a Cu (I) Salt: New Syntheses of Conjugate Diynes and Disubstited Ethynes“, The Journal of Organic Chemistry, 65 (6): 1780–1787, doi:10.1021 / jo991686k, PMID 10814151
- ^ A b Denmark, S.E .; Smith, R. C .; Chang, W.-T. T .; Muhuhi, J. M. (2009), „Cross-Coupling Reactions of Aromatic and Heteroaromatic Silanolates with Aromatic and Heteroaromatic Halides“, Journal of the American Chemical Society, 131 (8): 3104–3118, doi:10.1021 / ja8091449, PMC 2765516, PMID 19199785

![Obecné schéma pro spojení Hiyama { displaystyle { begin {matrix} {} { ce {{R-SiR '' _ {3}} + R'-X -> [ mathrm {F ^ {-}}]] [{ text {Pd cat.}}] R-R '}} end {matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45686837800f1a0e625c8ab13b8224dd6e26a10e)



