Kyselina dihydroxymalonová - Dihydroxymalonic acid
 | |
| Jména | |
|---|---|
| Název IUPAC Kyselina 2,2-dihydroxypropandiová | |
| Ostatní jména Kyselina dihydroxypropandiová Monohydrát kyseliny mesoxalové Monohydrát kyseliny oxomalonové Monohydrát kyseliny ketomalonové | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.008.372 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C3H4Ó6 | |
| Molární hmotnost | 136.059 g · mol−1 |
| Bod tání | 119 až 120 ° C (246 až 248 ° F; 392 až 393 K) |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
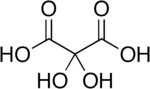
Kyselina dihydroxymalonová je organická sloučenina se vzorcem C.3H4Ó6 nebo HO- (C = O) -C (OH)2- (C = O) -OH, nalezený v některých rostlinách, jako je vojtěška a v řepa melasa.[2]
Sloučenina se také nazývá kyselina dihydroxymesoxalová a kyselina dihydroxypropandiová. Lze jej zobrazit jako a hydrát derivát kyselina mesoxalová, a je často nazýván monohydrát kyseliny mesoxalové a podobná jména.[3] Tato sloučenina neobvykle obsahuje stabilní geminal hydroxy skupiny.
Kyselina dihydroxymalonová je ve vodě rozpustná bílá pevná látka. To krystalizuje v rozmělněný hranoly které tají mezi 113 ° C a 121 ° C bez ztráty vody.[4] To bylo použito v lékařském výzkumu jako hypoglykemické činidlo[5] a byl patentován ve Spojených státech v roce 1997 jako rychle působící protijed na kyanid otrava.[6]
Syntéza
Kyselinu dihydroxymalonovou lze získat synteticky hydrolýza z alloxan s baryta voda,[2] oteplováním kyselina kávová[7] s octan olovnatý řešení,[4] elektrolýzou z kyselina vinná v alkalickém roztoku,[8] nebo z glycerol diacetát a koncentrovaný kyselina dusičná v chladu. Produkt lze získat také oxidací kyselina tartronová[9] nebo glycerol.[10]
Reakce
Stejně jako typické hydratované ketonové kyseliny se redukuje vodný roztok podle amalgám sodný na kyselina tartronová, a také kombinuje s fenylhydrazin a hydroxylamin. Snižuje to amoniakální stříbrný řešení. Při zahřátí s močovina do 100 ° C, tvoří se alantoin. Pokračujícím vařením vodného roztoku se rozkládá oxid uhličitý a kyselina glyoxylová.
Viz také
Reference
- ^ Index společnosti Merck, 12. vydání, 5971.
- ^ A b Deichsel, Theodor (1864). „Ueber die Mesoxalsäure“. J. Prakt. Chem. (v němčině). 93 (1): 193–208. doi:10.1002 / prac.18640930139.
- ^ E. T. Urbansky, W. J. Bashe (2000). Journal of Chromatography A, svazek 867, s. 143–149.
- ^ A b Henry Enfield Roscoe (1888), Pojednání o chemii, díl 3, část 2 Organická chemie, str. 161. D. Appleton and Co., New York.
- ^ Yoshito KOBAYASHI, Shigeru OHASHI, Shinzaburo TANAKA a Akitoshi SHIOYA (1955), Hypoglykemický účinek mesoxalátu sodného se zvláštním zřetelem na hyperfunkci kortikálního systému hypofýza-nadledvina u psů vystavených chladu[trvalý mrtvý odkaz ]. Sborník Japonské akademie, svazek 31, číslo 8, str. 493–497.
- ^ Způsob léčby otravy kyanidem
- ^ Chemická struktura kyseliny kávové byla uvedena v Allen, W. F. (1932). Příprava a pyrolytické molekulární přeskupení 8-etherů kofeinu: a jejich přeměna na 8-methyl a 8-ethylcaffein. Ann Arbor, Mich .: Edwards Brothers.
- ^ (1922), Chem. Zentralblatt III, 871
- ^ Ciriminna, Rosaria (2004). „Oxidace kyseliny tartronové a dihydroxyacetonu na mesoxalát sodný zprostředkovaný TEMPO“. Čtyřstěn dopisy. 45 (34): 6381–6383. doi:10.1016 / j.tetlet.2004.07.021.
- ^ Ciriminna, Rosaria (2003). „One-Pot Homogenní a heterogenní oxidace glycerolu na kyselinu ketomalonovou zprostředkovanou TEMPO“. Pokročilá syntéza a katalýza. 345 (3): 383–388. doi:10.1002 / adsc.200390043.
