Cyklobutanon - Cyclobutanone - Wikipedia
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.013.405 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4H6Ó | |
| Molární hmotnost | 70.091 g · mol−1 |
| Vzhled | Bezbarvá kapalina |
| Hustota | 0,9547 g / cm3 (0 ° C)[1] |
| Bod tání | −50,9 ° C (−59,6 ° F; 222,2 K)[1] |
| Bod varu | 99,75 ° C (212,55 ° F; 372,90 K)[1] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Cyklobutanon je organická sloučenina s molekulární vzorec (CH2)3CO. Je čtyřčlenný cyklický keton (cykloalkanon). Je to bezbarvá těkavá kapalina při pokojové teplotě. Od té doby cyklopropanon je vysoce citlivý, cyklobutanon je nejmenší, snadno manipulovatelný cyklický keton.
Příprava
Ruský chemik Nikolai Kischner poprvé připravil cyklobutanon v roce 1905.[2][3] Syntetizoval cyklobutanon v nízkém výtěžku z cyklobutankarboxylová kyselina v několika reakčních krocích. Tento proces je podle dnešních standardů těžkopádný a neefektivní.
 Syntéza cyklobutanonu z cyklobutankarboxylové kyseliny
Syntéza cyklobutanonu z cyklobutankarboxylové kyseliny
Od té doby byly vyvinuty efektivnější a vysoce výnosné syntézy.[4] Jedna strategie zahrnuje degradaci pěti uhlíkových stavebních bloků. Například oxidační dekarboxylace cyklobutankarboxylové kyseliny bylo vylepšeno použitím jiných reagencií a metod. Novější a účinnější přípravu cyklobutanonu nalezli P. Lipp a R. Köster, ve kterých řešení diazomethan v diethylether reaguje s keten.[5] Tato reakce je založena na kruhové expanzi cyklopropanon původně vytvořený meziprodukt, kde se odštěpí molekulární dusík. The mechanismus reakce byla potvrzena reakcí s použitím 14C-značený diazomethan.[6]
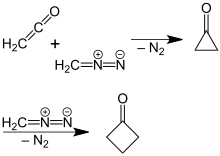 Příprava cyklobutanonu z diazomethanu a ketenu pomocí cyklopropanonu
Příprava cyklobutanonu z diazomethanu a ketenu pomocí cyklopropanonu
Další syntéza cyklobutanonu zahrnuje lithiem katalyzované přeskupení oxaspiropentanu, který je tvořen epoxidace snadno přístupných methylenecyklopropan.[7][8]
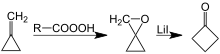 Příprava cyklobutanonu přesmykem
Příprava cyklobutanonu přesmykem
Cyklobutanon lze také připravit ve dvou krocích dialkylací sloučeniny 1,3-dithian s 1-brom-3-chlorpropanem s následnou deprotekcí na keton pomocí chlorid rtuťnatý (HgCl2) a uhličitan kademnatý (CdCO3).[9]
Reakce
Při asi 350 ° C se cyklobutanon rozkládá na ethylen a keten.[10] The aktivační energie pro tuto [2 + 2] cykloreverzi je 52 kcal / mol. Reverzní reakce, [2 + 2] cykloadice ketenu a ethylenu nebylo nikdy pozorováno.
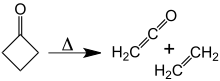 Rozklad cyklobutanonu
Rozklad cyklobutanonu
Viz také
Jiné cyklické ketony:
Reference
- ^ A b C CRC Handbook of Chemistry and Physics. 90. Boca Raton, Florida: CRC Press.
- ^ N. Kishner (1905). "'Über die Einwirkung von Brom auf die Amide α-bromsubstituierter Säuren “. Journal der Russischen Physikalisch-Chemischen Gesellschaft. 37: 103–105.
- ^ N. Kishner (1905). „Über das Cyklobutanon“. Journal der Russischen Physikalisch-Chemischen Gesellschaft. 37: 106–109.
- ^ Dieter Seebach (1971). „Isocyclische Vierringverbindungen“. V Houbenu; Weyl; Müller (eds.). Methoden der Organischen Chemie. IV / 4. Stuttgart: Georg Thieme Verlag.
- ^ P. Lipp und R. Köster (1931). „Ein neuer Weg zum Cyclobutanon“. Berichte der Deutschen Chemischen Gesellschaft. 64 (11): 2823–2825. doi:10.1002 / cber.19310641112.
- ^ Semenow, Dorothy A .; Cox, Eugene F .; Roberts, John D. (1956). "Sloučeniny s malým kruhem. XIV. Radioaktivní cyklobutanon z ketenu a diazomethanu-14C1". Journal of the American Chemical Society. 78 (13): 3221–3223. doi:10.1021 / ja01594a069.
- ^ Salaün, J. R .; Conia, J. M. (1971). "Oxaspiropentan. Rychlá cesta k cyklobutanonu". Journal of the Chemical Society D: Chemical Communications (23): 1579b-1580. doi:10.1039 / C2971001579B.
- ^ J. R. Salaün, J. Champion, J. M. Conia (1977). „Cyklobutanon z methylenecyklopropanu přes oxaspiropentan“. Organické syntézy. 57: 36. doi:10.15227 / orgsyn.057.0036.CS1 maint: více jmen: seznam autorů (odkaz); Kolektivní objem, 6, str. 320
- ^ D. Seebach, A. K. Beck (1971). „Cyklické ketony z 1,3-dithianu: cyklobutanon“. Organické syntézy. 51: 76. doi:10.15227 / orgsyn.051.0076.; Kolektivní objem, 6, str. 316
- ^ Das, M. N .; Kern, F .; Coyle, T. D .; Walters, W. D. (1954). "Tepelný rozklad cyklobutanonu1". Journal of the American Chemical Society. 76 (24): 6271–6274. doi:10.1021 / ja01653a013.




