Chirální bazén - Chiral pool - Wikipedia
The chirální bazén je „sbírka bohatých enantiopure stavebních bloků poskytovaných přírodou“ používaná při syntéze.[1][2] Přispěvateli do chirálního fondu jsou aminokyseliny, cukry, a terpeny. Jejich použití zvyšuje účinnost celková syntéza. Nejen, že chirální fond přispívá k premade uhlíkové kostře, jejich chirality je obvykle zachována ve zbytku reakční sekvence.
Tato strategie je obzvláště užitečná, pokud se požadovaná molekula podobá levným enantiočistým přírodním produktům. Mnohokrát nelze identifikovat vhodné enantiočisté výchozí materiály. Alternativou k použití chirálního bazénu je asymetrická syntéza, přičemž se používají achirální prekurzory nebo se štěpí racemické meziprodukty.
Příklady
Použití chirálního poolu je ilustrováno syntézou protirakovinného léčiva paclitaxel (Taxol). Začlenění prekurzoru C10 verbenonu, člena chirální skupiny, činí výrobu paclitaxelu efektivnější než většina alternativ.
K vybudování části se používá syntéza chirálního poolu epothilon (alternativa k paclitaxelu) ze snadno dostupného enantiopure (-) - pantolaktonu.[3]
Jiná použití chirálního bazénu
Kromě toho, že slouží jako stavební kameny v celková syntéza, je chirální bazén poklepán na výrobu asymetrické katalyzátory, chirální chránící skupiny, a agenti pro řešení problémů.[4]
- Chirální ligandy z chirálního poolu
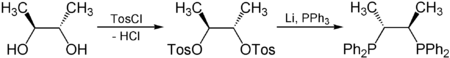
Asymetrická katalýza závisí na chirálních ligandech, které jsou zase obecně odvozeny z chirálního poolu. Například enantiopure 2,3-butandiol, odvozený z hojně dostupných kyselina vinná, se používá k syntéze chiraphos, složka katalyzátorů používaných pro asymetrickou hydrogenaci:[5]
- Chirální činidla z chirálního poolu

Diisopinokamfeylboran je organoboran to je užitečné pro asymetrická syntéza z sekundární alkoholy. Je odvozen od hydroborace z α-pinen, běžný diterpen člen chirálního fondu.[6]
- Roztoky z chirálního poolu
Mnoho, ne-li většina běžných štěpících činidel, jsou přírodní produkty nebo jejich deriváty. Ilustrativní je l-kyselina jablečná, dikarboxylová kyselina, která se nachází v jablkách. Používá se k řešení a-fenylethylamin, univerzální rozlišovací agent sám o sobě.[7]
Reference
- ^ Casiraghi, Giovanni .; Zanardi, Franca .; Rassu, Gloria .; Spanu, Pietro. (1995). „Stereoselektivní přístupy k bioaktivním sacharidům a alkaloidům - se zaměřením na nedávné syntézy čerpající z chirálního fondu“. Chemické recenze. 95 (6): 1677–1716. doi:10.1021 / cr00038a001.
- ^ Ulrich Klar; et al. (2005). „Efektivní syntéza chirálního fondu fragmentu epothilonů C1-C6“. Syntéza. 2005 (2): 301–305. doi:10.1055 / s-2004-834936.
- ^ Blaser, Hans Ulrich (1992). "Chirální fond jako zdroj enantioselektivních katalyzátorů a pomocných látek". Chemické recenze. 92 (5): 935–952. doi:10.1021 / cr00013a009.
- ^ M. D. Fryzuk, B. Bosnich (1977). "Asymetrická syntéza. Produkce opticky aktivních aminokyselin katalytickou hydrogenací". J. Am. Chem. Soc. 99 (19): 6262–6267. doi:10.1021 / ja00461a014. PMID 893889.
- ^ Lane, C. F .; Daniels, J. J. (1972). "(-) - Isopincampheol". Organické syntézy. 52: 59. doi:10.15227 / orgsyn.052.0059.
- ^ A. W. Ingersoll (1937). „D- A l-α-fenylethylamin“. Organické syntézy. 17: 80. doi:10.15227 / orgsyn.017.0080.



