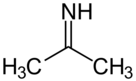
Acetonimin - Acetone imine
| |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC 2-propanimin | |||
| Systematický název IUPAC Propan-2-imin[1] | |||
Ostatní jména
| |||
| Identifikátory | |||
| ChemSpider | |||
| Pletivo | Imine Aceton Imine | ||
PubChem CID | |||
Řídicí panel CompTox (EPA) | |||
| Vlastnosti | |||
| C3H7N | |||
| Molární hmotnost | 57.096 g · mol−1 | ||
| Vzhled | bezbarvá kapalina | ||
| Hustota | 0,8 g cm−3 (25 ° C) | ||
| Bod varu | 57–59 ° C (330–332 K) | ||
| log P | -0.56 | ||
Index lomu (nD) | 1.394 | ||
| Nebezpečí | |||
| Piktogramy GHS |   | ||
| Signální slovo GHS | Nebezpečí | ||
| H225, H319, H336 | |||
| P210, P261, P305 + 351 + 338 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 14,7 ° C (58,5 ° F; 287,8 K) | ||
| Související sloučeniny | |||
Související sloučeniny | Acetonoxim | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Acetoniminnebo 2-propanimin je organická sloučenina a já těžím s chemický vzorec (CH3)2CNH. Je to nestálý a hořlavý kapalina při pokojová teplota. Je to nejjednodušší ketimin. Tento sloučenina je hlavně akademického zájmu.
Syntéza a reakce
Acetonimin se připravuje dehydrokyanací kyanoaminu acetonu, který se připravuje z acetonkyanhydrin. Dicyklohexylkarbodiimid (CyN = C = NCy) slouží jako mrchožrout pro kyanovodík:[2]
- (CH3)2C (NH2) CN + CyN = C = NCy → (CH3)2CNH + CyN (H) -C (CN) = NCy
 Po stání při teplotě místnosti se vzorky acetoniminu rozkládají za vzniku tohoto heterocyklu, který se nazývá acetonin.
Po stání při teplotě místnosti se vzorky acetoniminu rozkládají za vzniku tohoto heterocyklu, který se nazývá acetonin.
Sloučenina snadno hydrolyzuje:
- (CH3)2CNH + H2O → (CH3)2CO + NH3
Tato reaktivita je charakteristická pro iminy odvozené od amoniaku. Methylenimin (CH2= NH) je také vysoce reaktivní, kondenzuje na hexamethylentetramin. Po stání se imin podrobí další kondenzaci za vzniku tetrahydropyrimidin acetonin, se ztrátou amoniaku.[3]
Imine of hexafluoraceton, ((CF3)2C = NH) je naopak robustní.[4]
Reference
- ^ „Synonyma“. Pubchem.
- ^ K. Findeisen; H. Heitzer; K. Dehnicke (1981). „Neue Methode zur Herstellung von Aldiminen und Ketiminen“. Syntéza: 702–704. doi:10,1055 / s-1981-29566.
- ^ Matter, E. (1947). „Über ein neues Reaktionsprodukt aus Aceton und Ammoniak (Acetonin) (nový reakční produkt z acetonu a amoniaku (acetonin)) I“. Helvetica Chimica Acta. 30: 1114–23. doi:10,1002 / hlca.19470300503.
- ^ W. J. Middleton, H. D. Carlson (1970). "Hexafluoroaceton imin". Org. Syntézy. 50: 81–3. doi:10.15227 / orgsyn.050.0081..