Tris (dimethylamino) methan - Tris(dimethylamino)methane
 | |
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC N,N,N′,N′,N″,N″ -Hexamethylmethanetriamin | |
| Ostatní jména N,N,N,N,N,N-hexamethylmethanetriamin [bis (dimethylamino) methyl] dimethylamin | |
| Identifikátory | |
3D model (JSmol ) | |
| Informační karta ECHA | 100.024.804 |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C7H19N3 | |
| Molární hmotnost | 145.250 g · mol−1 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Tris (dimethylamino) methan (TDAM) je nejjednodušší představitel tris (dialkylamino) methanů obecného vzorce (R2N)3CH, ve kterém jsou tři ze čtyř atomů vodíku methanu nahrazeny dimethylaminoskupinami (-N (CH3)2).[1] Tris (dimethylamino) methan lze považovat za obojí amin a orthoamid.
Tris (dimethylamino) methan je silná báze a lze jej použít jako a formylační činidlo, tak jako aminomethylenační činidlo a jako zdroj pro základní bis (dimethylamino)karben vzorce (R.2N)2C∶.[2]
Příprava
Tris (dimethylamino) methan se tvoří při reakci N, N, N ', N'-tetramethylformamidiniumchlorid (TMF-Cl)[1][3][4] nebo bis (dimethylamino) acetonitril[5] s lithium dimethylamid nebo dimethylamid sodný s výnosy mezi 55 a 84%.[2]
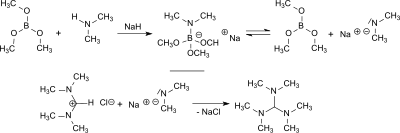
Z dimethylaminu a trimethoxyboran vzniká dimethylamid sodný in situ v přítomnosti hydrid sodný který reaguje s N,N,N′,N′ -Tetramethylformamidiniumchlorid v 84% výtěžku na tris (dimethylamino) methan a s bis (dimethylamino) acetonitrilem v 77% výtěžku.[6]
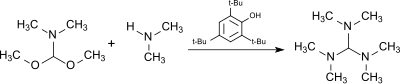
Reakce dimethylformamidu (DMF) dimethylacetalu, HC (OCH3)2N (CH3)2, (z DMF–komplex dimethylsulfátu a methoxid sodný[7]) s dimethylamin v přítomnosti kyselého katalyzátoru 2,4,6-tri-tert-butylfenol (což je do značné míry stabilní vůči alkylační činidlo ) produkuje tris (dimethylamino) methan.[8]
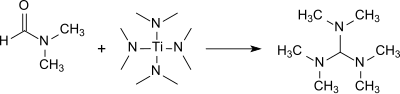
Tris (dimethylamino) methan se tvoří v dobrém výtěžku (83%) při reakci DMF s tetrakis (dimethylamino) titan (IV).[9]
N,N,N′,N′,N″,N″ -Hexamethylguanidinium chlorid (snadno získatelný dimethylaminem a N,N,N′,N′ -Tetramethylchloroformamidiniumchlorid odvozený od tetramethylmočovina a fosgen[10]) tvoří tris (dimethylamino) methan v 53% výtěžku vystavením redukčnímu činidlu sodnému bis (2-methoxyethoxy) aluminiumhydridu (Red-Al).[11]
Hydrid sodný a trimethylborát snížit N,N,N′,N′,N″,N″ -Hexamethylguanidiniumchlorid v 80% výtěžku k tris (dimethylamino) methanu.[6]
Vlastnosti
Tris (dimethylamino) methan je čirá, bezbarvá nebo světle žlutá kapalina se silným amoniakálním zápachem. Sloučenina je volně mísitelná s mnoha nepolárními aprotickými a bezvodými rozpouštědly. Při zahřátí však reaguje tris (dimethylamino) methan protická rozpouštědla (jako je voda nebo alkoholy), ale také se slabými CH-azidovými látkami, jako je např aceton nebo acetonitril.[2]
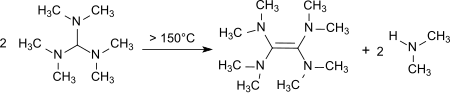
Při zahřátí na 150–190 ° C dochází k rozkladu s tvorbou tetrakis (dimethylamino) eten,[12] silný dárce elektronů.[13]
Aplikace
Tris (dimethylamino) methan disociuje na N,N,N′,N′ -Tetramethylformamidiniové kationty a dimethylamidové anionty, které oddělují protony od kyselých sloučenin CH- a NH. Takto vytvořené anionty se přidávají k formamidiniovým kationtům, které zase vylučují dimethylamin a reagují za vzniku dimethylaminomethylenových sloučenin (= CH-N (CH3)2) nebo amidiny aminomethyleneací.[1]
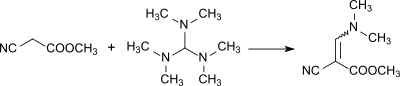
Reakce za vzniku methyl α-kyano-β-dimethylaminoakrylátu:
Reakce na vytvoření N,N-dimetyl-N′-str-nitrofenylformamidin:
Aminomethylenace poskytuje meziprodukty pro syntézu heterocyklů, jako jsou pyrimidiny, pyrazoly, 1,4-dihydropyridiny a indoly.
N,N,N′,N'-Tetramethylselenourea je přístupný rozšířeným ohřevem tris (dimethylamino) methanu s selen v xylen Jako meziprodukt se navrhuje bis (dimethylamino) karben.[14]
Reference
- ^ A b C Bredereck, H .; Effenberger, F .; Brendle, T. (1966). „Synthese und Reaktionen von Trisdimethylaminomethan“ [Syntéza a reakce tris (dimethylamino) methanu]. Angewandte Chemie (v němčině). 78 (2): 147–148. doi:10,1002 / ange.19660780212.
- ^ A b C Kantlehner, W. (2001). "Tris (dimethylamino) methan". Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Encyklopedie činidel pro organickou syntézu. doi:10.1002 / 047084289X.rt403. ISBN 0471936235.
- ^ DE 1217391, Bredereck, H .; Effenberger, F. & Brendle, T., „Verfahren zur Herstellung von Tris-dimethylaminomethan“, vydaný 08.12.1966, přidělený Bredereckovi, H.
- ^ Bredereck, H .; Effenberger, F .; Brendle, T .; Muffler, H. (1968). „Orthoamid. V. Synthese von Tris-dialkylamino-methanen“ [Orthoamides. V. Syntéza tris (dimethylamino) methanu]. Chemische Berichte (v němčině). 101 (5): 1885–1888. doi:10.1002 / cber.19681010541.
- ^ Kantlehner, W .; Maier, T .; Speh, P. (1979). „Tris (dialkylamino) methan a tetraalkylformamidinium-thiokyanát z Bis (dialkylamino) acetonitrilenu“ [Tris (dialkylamino) methany a tetraalkylformamidinium thiokyanatany z bis (dialkylamino) acetonitrilů]. Syntéza (v němčině). 1979 (5): 342–343. doi:10.1055 / s-1979-28671.
- ^ A b Kantlehner, W .; Stieglitz, R .; Hauber, M .; Haug, E .; Regele, C. (2000). „Orthoamid. LII. Beiträge zur Synthese von Orthocarbonsäureamiden“ [Orthoamides. LII. Články o syntéze orthoamidů karboxylových kyselin]. Journal für praktische Chemie (v němčině). 342 (3): 256–268. doi:10.1002 / (SICI) 1521-3897 (200003) 342: 3 <256 :: AID-PRAC256> 3.0.CO; 2-G.
- ^ Bredereck, H .; Effenberger, F .; Simchen, G. (1961). „Reaktionsfähige Säureamid-Dimethylsulfat-Komplexe“ [reaktivní komplexy amidu s dimethylsulfátem]. Angewandte Chemie (v němčině). 73 (14): 493. doi:10,1002 / ange.19610731407.
- ^ DE 2214497 „Leimgruber, W. & Wick, A. E.,„ Verfahren zur Herstellung eines aminosubstituierten Methanderivates “, vydaný 10. 10. 1972, přidělený společnosti F. Hoffmann-La Roche & Co. AG
- ^ Weingarten, H .; White, W. A. (1966). „Nová aminační reakce derivátů karboxylových kyselin s tetrakis (dimethylamino) titanem“. Journal of the American Chemical Society. 88 (4): 850. doi:10.1021 / ja00956a049.
- ^ Kantlehner, W .; Haug, E .; Mergen, W. W .; Speh, P .; Maier, T .; Kapassakalidis, J. J .; Bräuner, H. J .; Hagen, H. (1983). „Ein Herstellungsverfahren für N,N,N′,N′,N″,N″ -Hexaalkylguanidinium-chlorid “[Výrobní proces pro N,N,N′,N′,N″,N„Hexaalkylguanidinium chloridy]. Syntéza (v němčině). 1983 (11): 904–905. doi:10.1055 / s-1983-30558.
- ^ Kantlehner, W .; Speh, P .; Bräuner, H. J. (1983). „Eine einfache Synthese für Tris (dialkylamino) methane“ [Jednoduchá syntéza pro tris (dialkylamino) methany]. Syntéza (v němčině). 1983 (11): 905–906. doi:10.1055 / s-1983-30559.
- ^ Bredereck, H .; Effenberger, F .; Bredereck, H. J. (1966). "Eine neue Synthese von Tetra (dimethylamino) äthylen" [Nová syntéza tetra (dimethylamino) ethylenu]. Angewandte Chemie (v němčině). 78 (21): 984. doi:10,1002 / ange.19660782113.
- ^ Wiberg, N .; Buchler, J. W. (1962). „Tetrakis (dimethylamino) äthylen: Ein starker Elektronendonator“ [Tetrakis (dimethylamino) ethylen: silný donor elektronů]. Angewandte Chemie (v němčině). 74 (14): 490–491. doi:10,1002 / ange.19620741410.
- ^ Kantlehner, W .; Hauber, M .; Vettel, M. (1996). "Orthoamid. IL. Umsetzungen von Orthoamid-Derivaten mit Schwefel und Selen, Synthesen von 1,3-Thiazol- und 1,3-Selenazolderivaten" [Orthoamides. XLIX. Reakce derivátů orthoamidu se sírou a selenem, syntéza derivátů 1,3-thiazolu a 1,3-selenazolu]. Journal für praktische Chemie (v němčině). 338 (1): 403–413. doi:10.1002 / prac.19963380180.