Triboracyklopropenyl - Triboracyclopropenyl - Wikipedia

The triboracyklopropenyl fragment je a cyklický strukturální motiv v bór chemie, pojmenovaná pro svou geometrickou podobnost s cyklopropen. Na rozdíl od neplanárních shluky boranu které vykazují vyšší hodnoty koordinační čísla na boru (např. skrz 3-středové 2-elektronové vazby k přemostění hydridy nebo kationty ), struktury triboracyklopropenylového typu jsou kruhy tří atomů boru, kde jsou také substituenty na každém boru koplanární do ringu. Sloučeniny obsahující triboracyklopropenyl jsou extrémními případy anorganických látek aromatičnost. Jsou to nejlehčí a nejmenší cyklické struktury, o nichž je známo, že vykazují vazebné a magnetické vlastnosti, které pocházejí z plně delokalizované elektrony na orbitálech σ a π symetrie. Ačkoli trojčlenné kruhy boru jsou často velmi napjatý jako experimentálně nepřístupný, akademický zájem o jejich výraznou aromatičnost a možnou roli meziproduktů borane pyrolýza motivovaná rozsáhlými výpočetními studiemi od teoretičtí chemici.[1][2][3][4] Počínaje koncem 80. let 20. století hmotnostní spektrometrie dílo Andersona et al. na all-borových klastrech byly experimentální studie triboracyklopropenylů po celá desetiletí omezeny výlučně na zkoumání nejjednodušších kruhů (ionty B v plynné fázi)3).[4][5][6] Novější práce však stabilizovaly triboracyklopropenylovou část prostřednictvím koordinace s dárcem ligandy nebo přechodné kovy, což dramaticky rozšiřuje rozsah jeho chemie.[7][8][9][10]
Syntéza
Pro spektroskopické studie v plynné fázi se sloučeniny obsahující triboracyklopropenyl získají pomocí laserová ablace borových cílů a kolimace výsledného plazmatického mraku v proudu inertního nosného plynu, jako je helium. Nabité molekuly, které nás zajímají, jsou poté hromadně vybrány pomocí čas letu hmotnostní spektrometrie. Přidávání plynů, jako je N2 nebo CO proudu plynu poskytuje odpovídající adukty, zatímco přidání kovů, jako je iridium a vanadium k cíli B získá odpovídající shluky dopované kovem.[11]
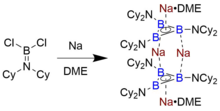
Jediný izolovaný příklad triboracyklopropenylového aniontu, který přetrvává v roztoku a v pevném stavu, identifikovali Braunschweig a spolupracovníci, kteří jej syntetizovali redukcí aminoboran Cl2B = NCy2 (Cy = cyklohexyl ) s jemně rozptýleným kovovým sodíkem v dimethoxyethan (DME).[7] Chlazení výsledného oranžovočerveného roztoku dimerního druhu Na4[B3(NCy2)3]2 • 2 DME vedly ke krystalům vhodným pro Rentgenová difrakce, kterým byla struktura určena. Ačkoli není podrobný redukční mechanismus znám, bylo navrženo, že subvalentní „R2N-B "meziprodukty se podílejí na tvorbě takových shluků boru.[12]
Struktura a lepení
Vzhledem ke svému zvláštnímu postavení nejjednodušších aromatických cyklů byla elektronová struktura derivátů triboracyklopropenylu analyzována různými technikami výpočetní chemie. Ty se pohybovaly od kanonických molekulární orbitální teorie k alternativním formulacím vazeb, jako je adaptivní teorie rozdělování přirozené hustoty,[13] the kvantová teorie atomů v molekulách, teorie orbitální přirozené vazby, přírodní orbitaly pro chemickou valenci[14] a elektronová lokalizační funkce analýza. NICS a výpočty kruhového proudu byly také použity k charakterizaci aromaticity v takových systémech pomocí magnetických kritérií.[15] Obecně platí, že extrémně malá velikost těchto cyklů znamená, že jejich vazebné elektrony mají značný Coulombův odpor, což má za následek abnormálně vysoké napětí v kruhu.[16] Tento efekt je částečně kompenzován stabilizací, kterou nabízí aromatická delokalizace.
B3+
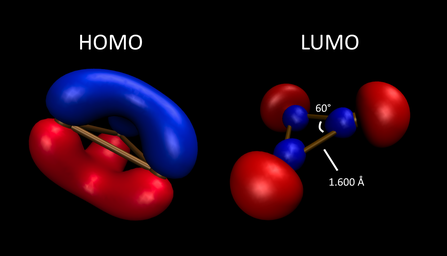
B3+ zobrazí π aromatičnost související s jeho A2'' -symetrický HOMO. Ve své tílko elektronický základní stav, to je a Hückel 2π elektronový systém analogický k cyklopropeniový kation, ale je příliš reaktivní, než aby byl izolován. Je trojúhelníkový, s D.3h symetrie - všechny jeho atomy B a vzdálenosti vazeb B-B jsou chemicky ekvivalentní. V plynné fázi se přidávají B3(N2)3+ a B3(CO)3+ byly výpočtově studovány pomocí teorie ETS-NOCV (rozšířený přechodový stav - přirozené orbitaly pro chemickou valenci), která rozkládá změny v energii a hustotě elektronů, které vznikají, když je molekula připravena z referenčního stavu neinteragujících fragmentů.[17] Analýza rozkladu energie ETS-NOCV naznačuje, že N2 a CO adukty jsou primárně stabilizovány (o -83,6, respektive -112,3 kcal / mol) prostřednictvím σ darování exocyklických ligandů do vysoce elektronově nedostatečného bórového kruhu. Výsledkem bylo, že každý byl interpretován jako B.3+ skupina podporovaná dativní vazba od N2 nebo CO. Hustota deformace elektronů vytvořená z NOCV tohoto systému, spolu s náboji odvozenými z orbitálních populací přirozené vazby, indikují tok elektronů z exocyklického ligandu do kruhu, který indukuje všechny ekvivalentní vazby B3+ jádro zkrátit přibližně o 16:00. Interakce π-symetrie jsou pozorovány jak u slabého donora σ N2 a silný π akceptorový ligand CO. Avšak backdonace π mimo rovinu (ze systému π B3 kruh na π akceptorové orbitaly každého ligandu) je méně stabilizující než in-plane π backdonace, se silami -26,7 a -19,6 kcal / mol pro [B3(CO)2+ + CO] systém. To naznačuje, že konfigurace minimální energie molekuly je taková, která zachovává maximální π aromatičnost v B3+ jádro.
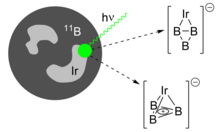
Stejně jako aromatické druhy jako cyklopentadienylový anion a cyklopropeniový kation se může koordinovat s přechodnými kovy, bylo nedávno prokázáno, že B3+ prsten se může vázat na kovové středy.[18] Laserová ablace smíšeného B / Ir cíle produkuje dva izomery IrB3−, B.3+ prsten koordinován do formálního Ir2- anion. Jedná se o pseudoplanární η2 adukt a čtyřboký η3 adukt, který obsahuje aromatický triboracyklopropenylový fragment. Oba jsou téměř identické v energii a koexistují v generovaném svazku hvězdokup.

Výpočty naznačují, že B3+ může dokonce vázat inertní atomy vzácného plynu za vzniku neobvyklé rodiny sloučenin B3(Rg)3+ (Rg = vzácný / vzácný plyn), s nezanedbatelnými pevnostmi vazby (od 15 do 30 kcal / mol), které pocházejí z Rg p-orbitální σ donicity a významného stupně přenosu náboje z Rg na B3+. Možnost nového sloučeniny vzácných plynů která se tvoří exotermicky a spontánně, je příležitostí pro experimentální práci.[19][21]
B3
B3 má samostatně obsazené a1„HOMO (a SOMO), které se skládá z σ-symetrických orbitalů orientovaných k jádru prstence, spojených s σ delokalizací a mírně kratšími délkami vazeb B-B ve srovnání s B3+. Je paramagnetický se základním stavem dubletu.[22] Je nepolární, plochý a trojúhelníkový, má D3h symetrie.
B3−
B3−, s vyplněným a1„HOMO v D3h symetrie, je považována za „dvojnásobně“ aromatickou a relativně stabilní - současně má ve svém HOMO a HOMO-1 vysoce delokalizované σ a π elektrony.[23][24]
B3R32-
B3R32-, formulovaný spíše s elektronovými sdíleními B-R vazbami než dativními šipkami, je vůči B izoelektronický3+. 8 elektronů je přiřazeno k triboracyklopenylovému jádru, 6 v orbitálech vazebných na σ a 2 v systému π, což vede k Hückelově aromatičnosti. Jedinou experimentálně charakterizovanou sloučeninou této třídy je Na4[B3(NCy2)3]2 • 2 DME, dimer skládaného B3R32- jednotky, které jsou samy o sobě aromatické.[7] Přirozená orbitální analýza vazby ukazuje, že tato sloučenina je vysoce stabilizována (zhruba o 45 kcal / mol) interakcí donor-akceptor lokalizovaných orbitálů vazby B-B s odpovídajícím B-N protivazným orbitálem přes kruh, kromě toho, že je spolu vázána elektrostatická přitažlivost k přemostění Na+ kationty identifikované v krystalové struktuře. DFT výpočty ukazují, že HOMO a HOMO-1 jsou antisymetrické a symetrické kombinace π HOMO jednotlivého kruhu - prvek sdílený s metaloceny. Jak se dalo očekávat u druhů s vazbami B-B, které mají formální pořadí MO vazeb , průměrná délka vazby B-B 1,62 Å je blíže délce diborenových (R-B = B-R) radikálových kationtů než B-B jednoduché vazby zhruba 1,75 Å.
Spektroskopie a spektrometrie
Sloučeniny odvozené od triboracyklopropenylu byly nejprve identifikovány podle poměru hmotnost k náboji jako přechodné druhy v hmotnostní spektrometrii komplexních směsí kationtových klastrů boru.[5] Studie reaktivního rozptylu s O2 brzy následovaly a odhalily relativně silnou vazbu uvnitř shluků lehkého boru.[6] Následně B3 byl izolován v matricích zmrazených vzácných plynů a elektronová paramagnetická rezonance byla zaznamenána spektra, která potvrdila jeho D3h geometrie.[22] Hyperjemné spojení nepárového elektronu s 11B jádro poskytlo odhad 15% s-orbitálního charakteru pro a1„HOMO. Malý a nepolární B3 prsteny se dokázaly volně otáčet a otáčet, i když byly uzavřeny v matrici.
Obecně platí, že druhy obsahující triboracyklopropenyl byly příliš krátké a byly produkovány v nedostatečném množství pro přenosový režim infračervená spektroskopie. Disociace B3(N2)3+ s infračerveným světlem a pozorování rozpadu odpovídajícího signálu hmotnost na náboj pomocí hmotnostní spektrometrie umožnilo efektivní infračervené spektrum B3(N2)3+ zaznamenat.[17][25] Toto vibrační fotodisociační spektrum obsahovalo pouze jednu detekovatelnou vibraci s červeným posunem 98 cm−1 vzhledem k plynnému N2, což naznačuje vysoce symetrický B.3(N2)3+ adukt s mírně oslabenou vazbou N≡N.
Negativně nabité ionty obsahující triboracyklopropenyl se ukázaly jako vhodné ke studiu fotoelektronová spektroskopie. Podle Koopmanova věta, zanedbávání účinků silných elektronová korelace, lze kinetické energie elektronů oddělených rentgenovými paprsky mapovat na vazebné energie jednotlivých orbitalů a odhalit molekulární elektronovou strukturu.[26][27] Rozdělení výsledných spektrálních vrcholů z „vibrační postup " (podle Franck-Condon Princip) ukazuje, jak ionizace při různých energiích mění specifické vibrační frekvence molekuly a tyto účinky na vazbu jsou interpretovány z hlediska změn konfigurace elektronů. V B3−bylo pozorováno neobvykle vysoké a vysoce energetické pásmo odpovídající multielektronovému nebo „shake-up“ přechodu (oddělení vázaných elektronů a elektronová excitace), což naznačuje silnou elektronovou korelaci přítomnou v triboracyklopropenylovém fragmentu.[4] Pro IrB3−, vibrační postup z protahovacích a dechových vibrací IrB3 lze přiřadit v překrývajících se spektrech obou izomerů přítomných ve svazku hvězdokup. Ve srovnání s výpočty je minimální energetická struktura IrB3 by pak mohl být formulován jako čtyřstěn s intaktní, aromatickou B3+ skupina.[8]
Reaktivita
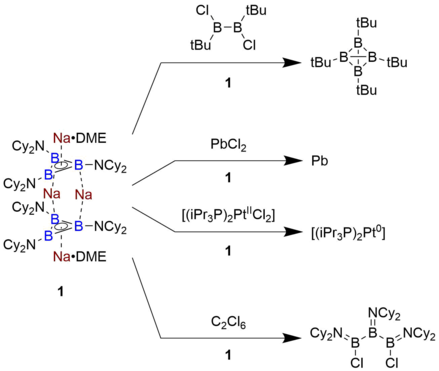
Reaktivita sloučenin obsahujících triboracyklopropenyl je poměrně málo prozkoumána, protože ve fázi roztoku byl připraven pouze jeden příklad. Sloučenina uváděná Braunschweigem, Na4[B3(NCy2)3]2 • 2 DME, je extrémně účinný redukční prostředek s oxidačním potenciálem -2,42 V vs. pár ferrocen / ferrocenium. Výsledkem je, že je schopen redukovat chlorborany za vzniku čtyřboká klastrů B, spolu s redukcí PbCl2 přímo na kovové Pb. Kromě toho podstoupí reakci otevření kruhu na B3 část abstrakcí atomů chloru z hexachlorethan. Tato úroveň redukční síly je zhruba srovnatelná s alkalickým kovem a nebyla dosud pozorována u žádné molekuly založené na organickém rámci.[7]
Ačkoli většina příkladů trinukleárních borových klastrů dopovaných přechodným kovem neobsahuje aromatický triboracyklopropenylový fragment, je pravděpodobné, že reaktivita těchto druhů s malými molekulami přiláká rostoucí vědecký zájem. Za podmínek hmotnostní spektrometrie bylo prokázáno, že VB3+ dehydrogenuje metan za získání produktů VB3CH2+ a H2. Menší vedlejší reakce, při které vzniká VH+ a vylučuje B3CH3 je také operativní.[10]
Viz také
Reference
- ^ McKee, Michael L .; Buehl, Michael; Charkin, Oleg P .; Schleyer, Paul v. R. (01.10.1993). "Teoretické zkoumání čtyřcentrálních dvou elektronových vazeb zahrnujících deriváty boru". Anorganická chemie. 32 (21): 4549–4554. doi:10.1021 / ic00073a014. ISSN 0020-1669.
- ^ Korkin, Anatoli A .; Schleyer, Paul v. R .; McKee, Michael L. (01.02.1995). "Teoretická ab Initio studie neutrálních a nabitých druhů B3Hn (n = 3-9). Důležitost aromatičnosti při určování strukturálních preferencí". Anorganická chemie. 34 (4): 961–977. doi:10.1021 / ic00108a031. ISSN 0020-1669.
- ^ Yang, C. L; Zhu, Z. H (2001-08-27). "Pozemní singlet a nízko položené tripletové elektronické stavy B3 +". Journal of Molecular Structure: THEOCHEM. 571 (1): 225–229. doi:10.1016 / S0166-1280 (01) 00558-9. ISSN 0166-1280.
- ^ A b C Zhai, Hua-Jin; Wang, Lai-Sheng; Alexandrova, Anastassia N .; Boldyrev, Alexander I .; Zakrzewski, Vyacheslav G. (01.11.2003). „Fotoelektronová spektroskopie a ab Initio studie aniontů B3- a B4- a jejich neutrálních látek“. The Journal of Physical Chemistry A. 107 (44): 9319–9328. Bibcode:2003JPCA..107,9319Z. doi:10.1021 / jp0357119. ISSN 1089-5639.
- ^ A b Hanley, Luke .; Anderson, Scott L. (01.09.1987). "Produkce a kolize vyvolaná disociace malých iontů klastru boru". The Journal of Physical Chemistry. 91 (20): 5161–5163. doi:10.1021 / j100304a007. ISSN 0022-3654.
- ^ A b Hanley, Luke; Anderson, Scott L. (01.09.1988). „Oxidace malých iontů klastru boru (B + 1–13) kyslíkem“. The Journal of Chemical Physics. 89 (5): 2848–2860. Bibcode:1988JChPh..89,2848H. doi:10.1063/1.454989. ISSN 0021-9606.
- ^ A b C d E F Kupfer, Thomas; Braunschweig, Holger; Radacki, Krzysztof (07.12.2015). „Triboracyclopropenyl Dianion: Nejsvětlejší možný prvek hlavní skupiny Hückel π Aromatic“. Angewandte Chemie International Edition. 54 (50): 15084–15088. doi:10,1002 / anie.201508670. PMID 26530854.
- ^ A b C Czekner, Joseph; Cheung, Ling Fung; Kocheril, G. Stephen; Kulichenko, Maksim; Boldyrev, Alexander I .; Wang, Lai-Sheng (2019-06-24). „Fotoelektronové zobrazení s vysokým rozlišením IrB 3 -: Pozorování π-aromatického prstence B 3 + koordinovaného s přechodovým kovem“. Angewandte Chemie International Edition. 58 (26): 8877–8881. doi:10.1002 / anie.201902406.
- ^ Chen, Xin; Chen, Teng-Teng; Li, Wan-Lu; Lu, Jun-Bo; Zhao, Li-Juan; Jian, Tian; Hu, Han-Shi; Wang, Lai-Sheng; Li, červen (01.01.2019). "Lanthanidy s neobvykle nízkými oxidačními stavy v klastrech PrB 3 a PrB 4 - boridy". Anorganická chemie. 58 (1): 411–418. doi:10.1021 / acs.inorgchem.8b02572. ISSN 0020-1669. PMID 30543295.
- ^ A b Chen, Qiang; Zhao, Yan-Xia; Jiang, Li-Xue; Li, Hai-Fang; Chen, Jiao-Jiao; Zhang, Ting; Liu, Qing-Yu; On, Sheng-Gui (2018). „Tepelná aktivace metanu klastry kationtů boridu vanadu VB n + (n = 3–6)“. Fyzikální chemie Chemická fyzika. 20 (7): 4641–4645. Bibcode:2018PCCP ... 20.4641C. doi:10.1039 / C8CP00071A. ISSN 1463-9076. PMID 29379936.
- ^ Jian, Tian; Chen, Xuenian; Li, Si-Dian; Boldyrev, Alexander I .; Li, červen; Wang, Lai-Sheng (2019). "Sondování struktur a lepení shluků bóru a dopovaného boru podle velikosti". Recenze chemické společnosti. 48 (13): 3550–3591. doi:10.1039 / C9CS00233B. ISSN 0306-0012. PMID 31120469.
- ^ Wrackmeyer, Bernd (2016). „Cyclotriborane Dianion and the Triboron Cation:„ Light Ends “of the Hückel Rule.“ Angewandte Chemie International Edition. 55 (6): 1962–1964. doi:10.1002 / anie.201510689. ISSN 1521-3773.
- ^ Tkachenko, Nikolay V .; Boldyrev, Alexander I. (08.05.2019). "Analýza chemických vazeb excitovaných stavů pomocí metody adaptivního dělení s přirozenou hustotou". Fyzikální chemie Chemická fyzika. 21 (18): 9590–9596. Bibcode:2019PCCP ... 21.9590T. doi:10.1039 / C9CP00379G. ISSN 1463-9084.
- ^ Mitoraj, Mariusz P .; Michalak, Artur; Ziegler, Tom (14.04.2009). "Schéma kombinovaného poplatku a rozkladu energie pro analýzu dluhopisů". Journal of Chemical Theory and Computation. 5 (4): 962–975. doi:10.1021 / ct800503d. ISSN 1549-9618. PMID 26609605.
- ^ Pham, Hung Tan; Lim, Kie Zen; Havenith, Remco W. A .; Nguyen, Minh Tho (2016-04-28). "Aromatický charakter planárních shluků na bázi boru, které byly znovu získány výpočty kruhového proudu". Fyzikální chemie Chemická fyzika. 18 (17): 11919–11931. Bibcode:2016PCCP ... 1811919P. doi:10.1039 / C5CP07391J. hdl:1854 / LU-8549871. ISSN 1463-9084. PMID 26956732.
- ^ Himmel, Hans-Jörg (2019-08-19). „Elektronově deficitní triboranové a tetraboranové kruhové sloučeniny: syntéza, struktura a vazba“. Angewandte Chemie International Edition. 58 (34): 11600–11617. doi:10.1002 / anie.201900563. PMID 30786130.
- ^ A b Jin, Jiaye; Wang, Guanjun; Zhou, Mingfei; Andrada, Diego M .; Hermann, Markus; Frenking, Gernot (05.02.2016). „Komplexy [B 3 (NN) 3] + a [B 3 (CO) 3] + s nejmenšími π-aromatickými druhy B 3 +“. Angewandte Chemie International Edition. 55 (6): 2078–2082. doi:10,1002 / anie.201509826. PMID 26836340.
- ^ Lichtenberger, Dennis L .; Hoppe, Martin L .; Subramanian, Lalitha; Kober, Edward M .; Hughes, Russell P .; Hubbard, John L .; Tucker, David S. (01.06.1993). "Distribuce elektronů a vazba v komplexech s 3-cyklopropenyl-kovem". Organometallics. 12 (6): 2025–2031. doi:10.1021 / om00030a011. ISSN 0276-7333.
- ^ A b C Li, Zhuo Zhe; Li, An Yong (2017-07-26). „Monocyklické aromatické sloučeniny BnRgn (n − 2) + boru a vzácných plynů“. Fyzikální chemie Chemická fyzika. 19 (29): 19109–19119. Bibcode:2017PCCP ... 1919109L. doi:10.1039 / C7CP00316A. ISSN 1463-9084. PMID 28702603.
- ^ Lu, Tian; Chen, Feiwu (2012). "Multiwfn: Multifunkční analyzátor vlnových funkcí". Journal of Computational Chemistry. 33 (5): 580–592. doi:10.1002 / jcc.22885. ISSN 1096-987X. PMID 22162017.
- ^ Saha, Ranajit; Pan, Sudip; Mandal, Subhajit; Orozco, Mesías; Merino, Gabriel; Chattaraj, Pratim K. (2016-08-17). „Klastr B3 + podporovaný vzácným plynem: tvorba silných kovalentních vazeb vzácného plynu a boru“. RSC zálohy. 6 (82): 78611–78620. doi:10.1039 / C6RA16188J. ISSN 2046-2069.
- ^ A b Hamrick, Y. M .; Van Zee, R. J .; Weltner, W. (02.02.1992). „Electron-spin rezonance a základní stavy borových a hliníkových trimerů“. The Journal of Chemical Physics. 96 (3): 1767–1775. Bibcode:1992JChPh..96.1767H. doi:10.1063/1.462132. ISSN 0021-9606.
- ^ Alexandrova, Anastassia N .; Boldyrev, Alexander I .; Zhai, Hua-Jin; Wang, Lai-Sheng (01.11.2006). „All-boron aromatic clusters as potential new anorganic ligands and building blocks in chemistry“. Recenze koordinační chemie. Chemie 18. hlavní skupiny. 250 (21): 2811–2866. doi:10.1016 / j.ccr.2006.03.032. ISSN 0010-8545.
- ^ Yang, Li-ming; Wang, Jian; Ding, Yi-hong; Sun, Chia-chung (29. 8. 2007). „Vyšetřování typické trojúhelníkové struktury B 3 v chemii boru: Pohled na holé klastry všech bórů používané jako ligandy nebo stavební bloky“. The Journal of Physical Chemistry A. 111 (37): 9122–9129. Bibcode:2007JPCA..111,9122Y. doi:10.1021 / jp074645y. ISSN 1089-5639. PMID 17725336.
- ^ Wang, GuanJun; Chi, ChaoXian; Xing, XiaoPeng; Ding, ChuanFan; Zhou, MingFei (01.01.2014). „Kolineární tandemový hmotnostní spektrometr doby letu pro infračervenou fotodisociační spektroskopii hmotnostně vybraných iontů“. Science China Chemistry. 57 (1): 172–177. doi:10.1007 / s11426-013-4979-5. ISSN 1869-1870.
- ^ Lineberger, W. Carl (01.04.2013). „Once Upon Anion: A Tale of Photodetachment“. Roční přehled fyzikální chemie. 64 (1): 21–36. Bibcode:2013ARPC ... 64 ... 21L. doi:10,1146 / annurev-physchem-032511-143753. ISSN 0066-426X.
- ^ Truhlar, Donald G .; Hiberty, Philippe C .; Shaik, Sason; Gordon, Mark S .; Danovich, David (02.09.2019). „Orbitály a interpretace fotoelektronové spektroskopie a (e, 2e) experimenty s ionizací“. Angewandte Chemie International Edition. 58 (36): 12332–12338. doi:10.1002 / anie.201904609.


