Acetylenediol - Acetylenediol
 | |
| Jména | |
|---|---|
| Ostatní jména ethyndiol, dihydroxyacetylen | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Vlastnosti | |
| C2H2Ó2 | |
| Molární hmotnost | 58,07 g / mol |
| Bod varu | rozkládá se |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
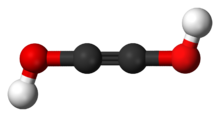
Acetylenediolnebo ethynediol, je chemická látka se vzorcem HO − C≡C − OH (an ynol ). To je diol z acetylén. Acetylenediol je v kondenzované fázi nestabilní tautomer glyoxal (CHO)2 je známý.
Detekce
Acetylenediol byl poprvé pozorován v plynné fázi hmotnostní spektrometrie.[1] Sloučenina byla později získána fotolýzou kyselina čtvercová v pevná argonová matice při 10 K (-263 ° C).[2]
Deriváty
Alkoxidové deriváty
Přestože diol má pouze letmý život v koncentrované formě, soli acetylenediolát (ethylendiolát) dianion −O-C≡C-O− jsou dobře známé. Tyto organokovové sloučeniny (konkrétně alkoxidy ) jsou formálně odvozeny od ethynediolu ztrátou dvou vodíkové ionty, ale normálně se tak nevytvářejí.
Typickým způsobem syntézy těchto solí je redukce oxidu uhelnatého. Acetylenediolát draselný (K.2C2Ó2) byl poprvé získán Liebig v roce 1834, z reakce kysličník uhelnatý s metalickým draslík;[3] ale po dlouhou dobu se předpokládalo, že produktem je „karbonyl draselný“ (KCO). Během příštích 130 let byly popsány „karbonyly“ sodík (Johannis, 1893), baryum (Gunz a Mentrel, 1903), stroncium (Roederer, 1906) a lithium, rubidium, a cesium (Pearson, 1933).[4] Ukázalo se, že reakce nakonec poskytla směs acetylenediolátu draselného K.
2C
2Ó
2 a benzenhexolát draselný K.
6C
6Ó
6.[5]
Skutečnou strukturu těchto solí objasnil až v roce 1963 Werner Büchner a E. Weiss.[6][7]
Acetylenedioláty lze také připravit rychlou reakcí CO a roztoku odpovídajícího kovu v kapalině amoniak při nízké teplotě.[4] Acetylenediolát draselný je světle žlutá pevná látka, která výbušně reaguje se vzduchem, halogeny, halogenovanými uhlovodíky, alkoholy, vodou a jakoukoli látkou, která obsahuje kyselý vodík.[8]
Koordinační komplexy
Může se tvořit acetylenediol koordinační sloučeniny, například [TaH (HOC≡COH) (dmpe)2Cl]+Cl− kde je dmpe bis (dimethylfosfino) ethan.[9]
Acetylenediolát a související anionty, jako je deltovat C
3Ó2−
3 a kvadrát C
4Ó2−
4 byly získány z oxidu uhelnatého za mírných podmínek redukční vazbou CO ligandů v organouranové komplexy.[10]
Ostatní deriváty
Ačkoli opět není odvozen z acetylenediolu, je známa celá řada strukturně příbuzných sloučenin. Mezi příklady patří diethery diisopropoxyethyn ((CH3)2CH) -O-C = C-O- (CH (CH3)2) a di-terc-butoxyethyn ((CH3)3C) -O-C = C-O- (C (CH3)3).[11]
Viz také
Reference
- ^ Terlouw, Johan K .; Burgers, Peter C .; van Baar, Ben L. M .; Weiske, Thomas; Schwarz, Helmut (1986). „Vznik v plynné fázi HO – CC – OH, H2N – CC – NH2, H2N – CC – OH a příbuzné sloučeniny selektivní redukcí jejich kationtů “. Chimia. 40: 357–359. Citováno 1. srpna 2009.
- ^ Maier, Günther; Rohr, Christine (1995). „Ethynediol: fotochemická generace a maticová spektroskopická identifikace“. Liebigs Annalen. 1996 (3): 307–309. doi:10,1002 / jlac.15719960304.
- ^ Justus Liebig (1834), Annalen der Chemie und Pharmacie, svazek 11, s. 182. Citováno Raymondem N. Vrtisem a kol. (1988), JACS str. 7564.
- ^ A b T. G. Pearson (1933), Karbonyly lithia, rubidia a cesia. Nature, svazek 131, s. 166–167 (4. února 1933). doi:10.1038 / 131166b0
- ^ Werner Büchner, E. Weiss (1964) Zur Kenntnis der sogenannten «Alkalicarbonyle» IV [1] Über die Reaktion von geschmolzenem Kalium mit Kohlenmonoxid. Helvetica Chimica Acta, Díl 47, číslo 6, strany 1415–1423.doi:10,1002 / hlca.19640470604
- ^ Werner Büchner, E. Weiss (1963) Zur Kenntnis der sogenannten «Alkalicarbonyle» I Die Kristallstruktur des Kalium-acetylendiolats, KOC≡COK. Helvetica Chimica Acta, svazek 46, číslo 4, strany 1121–1127. doi:10,1002 / hlca.19630460404
- ^ E. Weiss, Werner Büchner (1963), Zur Kenntnis der sogenannten Alkalicarbonyle. II. Die Kristallstrukturen des Rubidium- und Cesium-acetylendiolats, RbOC≡CORb und CsOC≡COCs. Zeitschrift für anorganische und allgemeine Chemie, svazek 330, číslo 5-6, strany 251–258. doi:10.1002 / zaac.19643300504
- ^ Charles Kenneth Taylor (1982), Chemické chování acetylenediolátů alkalických kovů. Práce, Pennsylvania State University; také Technical Memo A642321, Penn State University Park Applied Research Lab. 227 stránek.
- ^ Raymond N. Vrtis, Ch. Pulla Rao, Simon G. Bott a Stephen J. Lippard (1988), Syntéza a stabilizace tantalem koordinovaného dihydroxyacetylenu ze dvou redukčně vázaných ligandů oxidu uhelnatého J. Am. Chem. Soc., Svazek 110, vydání 22, s. 7564–7566. doi:10.1021 / ja00230a062
- ^ Alistair S. Frey, F. Geoffrey N. Cloke, Peter B. Hitchcock (2008), Mechanistické studie redukční cyklooligomerizace CO směsmi sendvičových komplexů U (III); molekulární struktura [(U (η-C8H6{Si'Pr3-1,4}2) (η-Cp*)]2(μ-η1: η1-C2Ó2) Journal of the American Chemical Society, svazek 130, číslo 42, strany 13816–13817. doi:10.1021 / ja8059792
- ^ Anna Bou, Miquel A. Pericàs a Félix Serratosa (1981), Diisopropoxy- a di-terc-butoxyethyn: Stabilní acetylenové dietethery. Tetrahedron, svazek 37, číslo 7, strany 1441-1449. doi:10.1016 / S0040-4020 (01) 92464-0
