Fotoaktivovaná lokalizační mikroskopie - Photoactivated localization microscopy
Fotoaktivovaná lokalizační mikroskopie (DLAŇ nebo FPALM)[1][2]a stochastická optická rekonstrukční mikroskopie (STORM)[3] jsou širokopásmová (na rozdíl od technik bodového skenování jako např laserové skenování konfokální mikroskopie ) fluorescenční mikroskopie zobrazovací metody, které umožňují získávání obrázků s rozlišením vyšším než difrakční limit. Metody byly navrženy v roce 2006 v důsledku obecného vzniku optických mikroskopie s vysokým rozlišením metody a byly představeny jako Metody roku pro rok 2008 Přírodní metody časopis.[4]Vývoj PALM jako cílené biofyzikální zobrazovací metody byl do značné míry podnícen objevem nových druhů a inženýrstvím mutantů fluorescenčních proteinů vykazujících kontrolovatelný fotochromismus, například fotoaktivovatelné GFP. Souběžný vývoj STORM, sdílející stejný základní princip, však původně využíval spárované kyanin Jedna molekula páru (nazývaná aktivátor), je-li vzrušena blízko absorpčního maxima, slouží k reaktivaci druhé molekuly (nazývané reportér) do fluorescenčního stavu.
Pro PALM, STORM a související techniky se používá rostoucí počet barviv, a to jak organických fluoroforů, tak fluorescenčních proteinů. Některé jsou kompatibilní se zobrazováním živých buněk, jiné umožňují rychlejší získání nebo hustší označení. Volba konkrétního fluoroforu nakonec závisí na aplikaci a na jejích fotofyzikálních vlastnostech.[5]
Obě techniky prošly významným technickým vývojem,[6] zejména umožnění vícebarevného zobrazování a rozšíření do tří dimenzí, s nejlepším proudovým axiálním rozlišením 10 nm ve třetí dimenzi dosaženým pomocí interferometrického přístupu se dvěma protilehlými cíli sběru fluorescence ze vzorku.[7]
Zásada
Konvenční fluorescenční mikroskopie se provádí selektivním barvením vzorku fluorescenční molekuly, buď spojené s protilátkami jako v imunohistochemie nebo použitím fluorescenčních proteinů geneticky fúzovaných s požadovanými geny. Typicky, čím koncentrovanější jsou fluorofory, tím lepší je kontrast fluorescenčního obrazu.
Jediný fluorofor lze vizualizovat pod mikroskopem (nebo dokonce pouhým okem)[8]) je-li počet emitovaných fotonů dostatečně vysoký a naopak pozadí je dostatečně nízké. Dvourozměrný obraz bodového zdroje pozorovaný pod mikroskopem je rozšířené místo, které odpovídá Vzdušný disk (část funkce rozložení bodů ) zobrazovacího systému. Schopnost identifikovat jako dva jednotlivé subjekty dva těsně rozmístěné fluorofory je omezena difrakce světla. To je kvantifikováno Abbe Kritérium uvádí, že minimální vzdálenost který umožňuje řešení dvou bodových zdrojů je dán
kde je vlnová délka fluorescenční emise a NA je numerická clona mikroskopu. Teoretický limit rozlišení při nejkratší praktické vlnové délce excitace je kolem 150 nm v laterální dimenzi a blíží se 400 nm v axiální dimenzi (pokud se používá objektiv s numerickou aperturou 1,40 a excitační vlnová délka je 400 nm).
Pokud se však dá rozlišit emise ze dvou sousedních fluorescenčních molekul, tj. Lze identifikovat fotony přicházející z každé ze dvou, pak je možné překonat difrakční limit.[9] Jakmile se shromáždí sada fotonů ze specifické molekuly, vytvoří v obrazové rovině mikroskopu difrakčně omezené místo. Střed tohoto bodu lze nalézt přizpůsobením pozorovaného emisního profilu známé geometrické funkci, obvykle a Gaussian funkce ve dvou rozměrech. Chyba způsobená lokalizací středu vysílače bodu se změní na první aproximaci jako inverzní odmocnina počtu emitovaných fotonů, a pokud se shromáždí dostatek fotonů, je snadné získat chybu lokalizace mnohem menší než původní bod funkce šíření.

Dva kroky identifikace a lokalizace jednotlivých fluorescenčních molekul v hustém prostředí, kde je jich mnoho, jsou základem PALM, STORM a jejich vývoje.
Ačkoli existuje mnoho přístupů k molekulární identifikaci, fotochromismus vybraných fluoroforů vyvolaný světlem se vyvinul jako nejslibnější přístup k rozlišení sousedních molekul oddělením jejich fluorescenční emise v čase. Zapnutím stochasticky řídkých podmnožin fluoroforů se světlem specifické vlnové délky pak mohou být jednotlivé molekuly vzrušeny a zobrazeny podle jejich spekter. Aby se zabránilo hromadění aktivních fluoroforů ve vzorku, které by se nakonec degradovaly zpět na obraz s omezenou difrakcí, spontánně se vyskytující jev fotobělení je využíván v PALM, zatímco reverzibilní přepínání mezi fluorescenčním zapnutým stavem a tmavým vypnutým stavem barviva je využíváno v STORM.
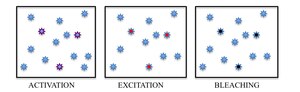
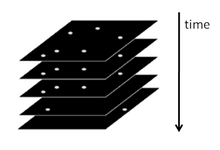
Stručně řečeno, PALM a STORM jsou založeny na shromažďování pod fluorescenčním mikroskopem velkého počtu obrazů, z nichž každý obsahuje jen několik aktivních izolovaných fluoroforů. Zobrazovací sekvence umožňuje mnoho emisních cyklů nezbytných pro stochastickou aktivaci každého fluoroforu z neemisního (nebo méně emisní) do jasného stavu a zpět do neemisivního nebo běleného stavu. Během každého cyklu je hustota aktivovaných molekul udržována dostatečně nízká, aby se molekulární obrazy jednotlivých fluoroforů obvykle nepřekrývaly.

Lokalizace jednotlivých fluoroforů
V každém snímku sekvence se poloha fluoroforu počítá s přesností obvykle větší než je difrakční limit - v typickém rozsahu několika až desítek nm - a výsledná informace o poloze středů všech lokalizovaných molekuly se používá k vytvoření obrazu PALM nebo STORM ve vysokém rozlišení.
Přesnost lokalizace lze vypočítat podle vzorce:
kde N je počet sebraných fotonů, a je velikost pixelu zobrazovacího detektoru, je průměrný signál na pozadí a je směrodatná odchylka funkce šíření bodu.[10]Požadavek lokalizace více fluoroforů současně na rozšířené ploše určuje důvod, proč jsou tyto metody široké pole využívající jako detektor CCD, EMCCD nebo a CMOS Fotoaparát.
Požadavek na lepší odstup signálu od šumu maximalizovat přesnost lokalizace určuje častou kombinaci tohoto konceptu s širokoúhlými fluorescenčními mikroskopy umožňujícími optické krájení, jako např fluorescenční mikroskopy s vnitřním odrazem (TIRF) a fluorescenční mikroskopy z lehkého plechu.
Obrázek se super rozlišením
Rozlišení konečného obrazu je omezeno přesností každé lokalizace a počtem lokalizací, nikoli difrakcí. Obraz v super rozlišení je tedy a pointilistický reprezentace souřadnic všech lokalizovaných molekul. Obrázek se super rozlišením se běžně vykresluje tak, že každá molekula v obrazové rovině je představována jako dvourozměrný Gaussian s amplitudou úměrnou počtu sebraných fotonů a směrodatnou odchylkou v závislosti na přesnosti lokalizace.

Aplikace
Vícebarevná PALM / STORM

Zvláštní fotofyzikální vlastnosti fluoroforů používaných při zobrazování superrozlišení PALM / STORM představují jak omezení, tak příležitosti pro vícebarevné zobrazování. Doposud se objevily tři strategie: excitace spektrálně oddělených fluoroforů pomocí emisního děliče paprsků,[12] použití více aktivátorů / reportérů v režimu STORM[13][14] a poměrové zobrazování spektrálně blízkých fluoroforů.[15]
3D v PALM a STORM
Ačkoli byly PALM a STORM původně vyvinuty jako zobrazovací metody 2D (x, y), rychle se vyvinuly v techniky schopné 3D (x, y, z). K určení osové polohy jednoho fluoroforu ve vzorku se v současné době používají následující přístupy: modifikace funkce šíření bodů za účelem zavedení funkcí závislých na Z ve 2D (x, y) obrazu (nejběžnějším přístupem je zavedení astigmatismus v PSF); detekce více rovin, kde je axiální poloha určena porovnáním dvou obrazů stejného PSF rozostřeného jednoho vzhledem k druhému; interferometrický stanovení osové polohy vysílače pomocí dvou protilehlých cílů a více detektorů;[7] Použití časové zaostření omezit buzení / aktivaci; Použití lehký list excitace / aktivace omezit na několik stovek nanometrů tlustou vrstvu libovolně umístěnou podél roviny z ve vzorku.
Živé zobrazení buněk
Požadavek na více cyklů aktivace, buzení a deaktivace / bělení by typicky znamenal prodloužené časové úseky pro vytvoření obrazu PALM / STORM, a tedy provoz na pevném vzorku. Řada prací byla publikována již v roce 2007 [16] provádění PALM / STORM na živých buňkách. Schopnost provádět živé zobrazování v super rozlišení pomocí těchto technik nakonec závisí na technických omezeních sběru dostatku fotonů z jediného vysílače ve velmi krátkém čase. To závisí jak na fotofyzikálních omezeních sondy, tak na citlivosti použitého detektoru. Relativně pomalé (sekundy až desítky sekund) procesy, jako je modifikace organizace fokální adheze byly vyšetřovány pomocí PALM,[17] vzhledem k tomu, že STORM umožnil zobrazování rychlejších procesů, jako je membránová difúze jamek potažených klatrinem nebo mitochondriální štěpení / fúzní procesy. Slibnou aplikací PALM živých buněk je použití fotoaktivace k provedení sledování s vysokou hustotou jednotlivých částic (sptPALM [18]), překonávající tradiční omezení sledování jednotlivých částic pracovat se systémy vykazujícími velmi nízkou koncentraci fluoroforů.
Nanofotonické interakce
Zatímco k určení fyzické struktury vzorku se používají tradiční měření PALM a STORM, přičemž intenzita fluorescenčních událostí určuje jistotu lokalizace, lze tyto intenzity také použít k mapování interakcí fluoroforů s nanofotonické struktur. To bylo provedeno na obou kovových (plazmonický ) struktury, jako jsou zlaté nanorody,[19][20] stejně jako polovodičové struktury, jako jsou křemíkové nanodráty.[21]Tyto přístupy lze použít buď pro fluorofory funkcionalizované na povrchu sledovaného vzorku (jako u zde zmíněných studií plazmonických částic), nebo náhodně adsorbované na substrát obklopující vzorek, což umožňuje úplné 2D mapování interakcí fluoroforu a nanostruktury na všech pozicích vzhledem ke struktuře.[21]
Tyto studie zjistily, že kromě standardní nejistoty lokalizace způsobené funkce rozložení bodů přizpůsobení, vlastní interference se světlem rozptýleným nanočásticemi může vést k narušení nebo posunutí funkcí šíření zobrazených bodů,[20][21] což komplikuje analýzu těchto měření. Je však možné je omezit, například začleněním metasurface masky, které řídí povolené úhlové rozložení světla do měřicího systému.[22]
Rozdíly mezi PALM a STORM
PALM a STORM sdílejí společný základní princip a řada vývojových tendencí tyto dvě techniky ještě více propojila. Přesto se liší v několika technických detailech a zásadním bodě. Po technické stránce se PALM provádí na biologickém vzorku pomocí fluoroforů exprimovaných exogenně ve formě genetických fúzních konstruktů na fotoaktivovatelný fluorescenční protein. STORM místo toho používá imunoznačení endogenních molekul ve vzorku s protilátkami značenými organickými fluorofory. V obou případech jsou fluorofory poháněny světlem mezi aktivním a neaktivním stavem. V PALM však fotoaktivace a odbarvování omezují životnost fluoroforu na omezený časový interval a je žádoucí kontinuální emise fluoroforu mezi nimi bez jakékoli přerušované fluorescence. V STORM stochastické fotoblinkování organických fluoroforů (obvykle jasnějších než fluorescenční proteiny) bylo původně využito k oddělení sousedních barviv. V tomto ohledu platí, že čím robustnější blikání, tím vyšší je pravděpodobnost rozlišení dvou sousedních fluoroforů.
V tomto ohledu několik výzkumných prací prozkoumalo potenciál PALM provést kvantifikaci počtu fluoroforů (a tedy zájmových proteinů) přítomných ve vzorku spočítáním aktivovaných fluoroforů.[11][23][24] Přístup použitý k léčbě fluorescenční dynamiky fluorescenční značky použité v experimentech určí konečný vzhled obrazu s vysokým rozlišením a možnost stanovení jednoznačné korespondence mezi lokalizační událostí a proteinem ve vzorku.
Multimédia
Imobilizované fluorescenční proteiny jsou fotoaktivovány, vzrušeny a běleny
Dynamické zobrazování dendritických ostnů se super rozlišením pomocí fotokonvertibilního aktinu s nízkou afinitou.[25]
Zkoumání dynamiky aktinu sub-páteře u hipokampálních neuronů krys pomocí optické mikroskopie se super rozlišením [26]
Reference
- ^ E. Betzig; G. H. Patterson; R. Sougrat; O. W. Lindwasser; S. Olenych; J. S. Bonifacino; M. W. Davidson; J. Lippincott-Schwartz; H. F. Hess (2006). „Zobrazování intracelulárních fluorescenčních proteinů při rozlišení nanometrů“. Věda. 313 (5793): 1642–1645. Bibcode:2006Sci ... 313.1642B. doi:10.1126 / science.1127344. PMID 16902090.
- ^ S. T. Hess; T. P. Giriajan; M. D. Mason (2006). „Zobrazování v ultravysokém rozlišení pomocí mikroskopie s fluorescenční fotoaktivační lokalizací“. Biofyzikální deník. 91 (11): 4258–4272. Bibcode:2006BpJ .... 91,4258H. doi:10.1529 / biophysj.106.091116. PMC 1635685. PMID 16980368.
- ^ M. J. Rust; M. Bates; X. Zhuang (2006). „Subdifrakční mezní zobrazení stochastickou optickou rekonstrukční mikroskopií (STORM)“. Přírodní metody. 3 (20): 793–796. doi:10.1038 / nmeth929. PMC 2700296. PMID 16896339.
- ^ „Metoda roku 2008“. Přírodní metody. 6 (1): 1–109. 2009. doi:10.1038 / nmeth.f.244.
- ^ Ha, Taekjip & Tinnefeld, Philip (2012). „Fotofyzika fluorescenčních sond pro monomolekulární biofyziku a zobrazování ve vysokém rozlišení“. Roční přehled fyzikální chemie. 63 (1): 595–617. Bibcode:2012ARPC ... 63..595H. doi:10.1146 / annurev-physchem-032210-103340. PMC 3736144. PMID 22404588.
- ^ Bo Huang a Hazen Babcock a Xiaowei Zhuang (2010). „Překročení difrakční bariéry: zobrazování buněk s vysokým rozlišením“. Buňka. 143 (7): 1047–58. doi:10.1016 / j.cell.2010.12.002. PMC 3272504. PMID 21168201.
- ^ A b Shtengel, Gleb a Galbraith, James A. a Galbraith, Catherine G. a Lippincott-Schwartz, Jennifer a Gillette, Jennifer M. a Manley, Suliana a Sougrat, Rachid a Waterman, Clare M. a Kanchanawong, Pakorn a Davidson, Michael W. a Fetter, Richard D. a Hess, Harald F. (2009). „Interferometrická fluorescenční mikroskopie s vysokým rozlišením řeší 3D buněčnou ultrastrukturu“. Sborník Národní akademie věd. 106 (9): 3125–3130. Bibcode:2009PNAS..106.3125S. doi:10.1073 / pnas.0813131106. PMC 2637278. PMID 19202073.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ W. E. Moerner; D. P. Fromm (2003). „Metody jednomolekulární fluorescenční spektroskopie a jednotlivých fluorescenčních sond“. Recenze vědeckých přístrojů. 74 (8): 3597–3619. Bibcode:2003RScI ... 74,3597 mil. doi:10.1063/1.1589587.
- ^ E. Betzig (1995). "Navržená metoda pro molekulární optické zobrazování". Optická písmena. 20 (3): 237–239. Bibcode:1995OptL ... 20..237B. doi:10,1364 / OL. 20 000237. PMID 19859146.
- ^ K. I. Mortensen; L. S. Churchman; J. A. Spudich; H. Flyvbjerg (2010). „Optimalizovaná lokalizační analýza pro sledování jedné molekuly a mikroskopii s vysokým rozlišením“. Přírodní metody. 7 (5): 377–381. doi:10.1038 / nmeth.1447. PMC 3127582. PMID 20364147.
- ^ A b Greenfield D, McEvoy AL, Shroff H, Crooks GE, Wingreen NS a kol. (2009). „Samoorganizace sítě chemotaxe Escherichia coli zobrazená pomocí světelné mikroskopie s vysokým rozlišením“. PLOS Biology. 7 (6): e1000137. doi:10.1371 / journal.pbio.1000137. PMC 2691949. PMID 19547746.
- ^ Shroff H, Galbraith CG, Galbraith JA, White H, Gillette J, Olenych S, Davidson MW, Betzig E (2007). „Dvoubarevné zobrazování superrozlišení geneticky exprimovaných sond v jednotlivých adhezních komplexech“. Sborník Národní akademie věd. 104 (51): 20308–20313. Bibcode:2007PNAS..10420308S. doi:10.1073 / pnas.0710517105. PMC 2154427. PMID 18077327.
- ^ M Bates; B Huang; GT Dempsey; X Zhuang (2007). „Vícebarevné zobrazování v super rozlišení s fotovoltaickými fluorescenčními sondami“. Věda. 317 (5845): 1749–1753. Bibcode:2007Sci ... 317.1749B. doi:10.1126 / science.1146598. PMC 2633025. PMID 17702910.
- ^ Bock, H .; et al. (2007). „Dvoubarevná fluorescenční nanoskopie se vzdáleným polem založená na fotopřepínatelných zářičích“. Aplikovaná fyzika B. 88 (2): 161–165. Bibcode:2007ApPhB..88..161B. doi:10.1007 / s00340-007-2729-0.
- ^ Testa I, Wurm CA, Medda R, Rothermel E, von Middendorf C, Folling J, Jakobs S, Schonle A, Hell SW, Eggeling C (2010). „Vícebarevná fluorescenční nanoskopie ve fixních a živých buňkách vzrušováním konvenčních fluoroforů s jedinou vlnovou délkou“. Biofyzikální deník. 99 (8): 2686–2694. Bibcode:2010BpJ .... 99.2686T. doi:10.1016 / j.bpj.2010.08.012. PMC 2956215. PMID 20959110.
- ^ Hess, Samuel T. a Gould, Travis J. a Gudheti, Manasa V. a Maas, Sarah A. a Mills, Kevin D. a Zimmerberg, Joshua (2007). „Dynamická shluková distribuce hemaglutininu vyřešená při 40 nm v membránách živých buněk rozlišuje mezi teoriemi vorů“. Sborník Národní akademie věd. 104 (44): 17370–17375. Bibcode:2007PNAS..10417370H. doi:10.1073 / pnas.0708066104. PMC 2077263. PMID 17959773.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Shroff, H., C. G. Galbraith, J. A. Galbraith a E. Betzig (2008). „Fotoaktivovaná lokalizační mikroskopie živých buněk s dynamikou adheze v nanoměřítku“. Přírodní metody. 5 (44): 417–423. doi:10.1038 / nmeth.1202. PMC 5225950. PMID 18408726.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ S Manley; J M Gillette; GH Patterson; H Shroff; H F Hess; E Betzig; J. Lippincott-Schwartz (2008). „Mapování jedné molekuly trajektorií s vysokou hustotou pomocí fotoaktivované lokalizační mikroskopie“. Přírodní metody. 5 (2): 155–157. doi:10.1038 / nmeth.1176. PMID 18193054.
- ^ Zhou, Xiaochun; Andoy, Nesha May; Liu, Guokun; Choudhary, Eric; Han, Kyu-Sung; Shen, Hao; Chen, Peng (2012). „Kvantitativní zobrazování s vysokým rozlišením odhaluje vzorce reaktivity na jednotlivých nanokatalyzátorech“. Přírodní nanotechnologie. 7 (4): 237–241. Bibcode:2012NatNa ... 7..237Z. doi:10.1038 / nnano.2012.18. ISSN 1748-3387. PMID 22343380.
- ^ A b Lin, Hongzhen; Centeno, Silvia P .; Su, Liang; Kenens, Bart; Rocha, Susana; Sliwa, Michel; Hofkens, Johan; Uji-i, Hiroshi (2012). "Mapování povrchově zesílené fluorescence na kovových nanočásticích pomocí mikroskopie pro lokalizaci fotaktivace s vysokým rozlišením". ChemPhysChem. 13 (4): 973–981. doi:10.1002 / cphc.201100743. ISSN 1439-4235. PMID 22183928.
- ^ A b C Johlin, Eric; Solari, Jacopo; Mann, Sander A .; Wang, Jia; Shimizu, Thomas S .; Garnett, Erik C. (2016). „Zobrazování interakcí světelné hmoty se superrozlišením v blízkosti jednotlivých polovodičových nanodrátů“. Příroda komunikace. 7: 13950. Bibcode:2016NatCo ... 713950J. doi:10.1038 / ncomms13950. ISSN 2041-1723. PMC 5187462. PMID 27996010.
- ^ Backlund, Mikael P .; Arbabi, Amir; Petrov, Petar N .; Arbabi, Ehsan; Saurabh, Saumya; Faraon, Andrei; Moerner, W. E. (2016). „Odstranění zkreslení lokalizace vyvolaných orientací v mikroskopii s jednou molekulou pomocí širokopásmové metasurface masky“ (PDF). Fotonika přírody. 10 (7): 459–462. Bibcode:2016NaPho..10..459B. doi:10.1038 / nphoton.2016.93. ISSN 1749-4885. PMC 5001689. PMID 27574529.
- ^ P Annibale; S Vanni; M Scarselli; U Rothlisberger; Radenovic (2011). „Kvantitativní fotoaktivovaná lokalizační mikroskopie: Odhalování účinků fotoblinků“. PLOS ONE. 6 (7): p.e22678, 07. Bibcode:2011PLoSO ... 622678A. doi:10.1371 / journal.pone.0022678. PMC 3144238. PMID 21818365.
- ^ Lee, Sang-Hyuk a Shin, Jae Yen a Lee, Antony a Bustamante, Carlos (2012). „Počítání jednotlivých fotoaktivovatelných fluorescenčních molekul fotoaktivovanou lokalizační mikroskopií (PALM)“. Sborník Národní akademie věd. 109 (43): 17436–17441. Bibcode:2012PNAS..10917436L. doi:10.1073 / pnas.1215175109. PMC 3491528. PMID 23045631.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Izeddin I, Specht CG, Lelek M, Darzacq X, Triller A a kol. (2011). „Dynamické zobrazování dendritických ostnů se superrozlišením pomocí fotokonvertibilní aktinové sondy s nízkou afinitou“. PLOS ONE. 6 (1): e15611. Bibcode:2011PLoSO ... 615611I. doi:10.1371 / journal.pone.0015611. PMC 3022016. PMID 21264214.
- ^ Tatavarty V, Kim E, Rodionov V, Yu J (2009). „Vyšetřování dynamiky aktinu sub-páteře u hipokampálních neuronů krys pomocí optického zobrazování s vysokým rozlišením“. PLOS ONE. 4 (11): e7724. doi:10,1371 / journal.pone.0007724. PMC 2771285. PMID 19898630.
externí odkazy
- Superrozlišovací mikroskopie v rámci vzdělávací stránky Zeiss v oblasti mikroskopie a digitálního zobrazování
- Základní koncepty v super rozlišení v rámci vzdělávacích zdrojů společnosti Nikon pro výuku mikroskopie
- Eric Betzig a Harald Hess mluví: Vývoj mikroskopie PALM
- Přednáška Xiaowei Zhuang: Mikroskopie se super rozlišením
- Světelná mikroskopie: probíhající moderní revoluce (úvodní recenze)












