Fluorescenční mikroskop s vnitřním odrazem - Total internal reflection fluorescence microscope
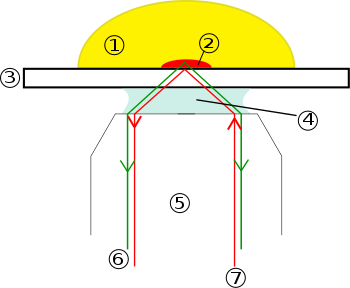
- Vzorek
- Evanescentní vlnový rozsah
- Krycí sklíčko
- Ponorný olej
- Objektivní
- Emisní paprsek (signál)
- Budicí paprsek

- Objektivní
- Emisní paprsek (signál)
- Ponorný olej
- Krycí sklíčko
- Vzorek
- Evanescentní vlnový rozsah
- Budicí paprsek
- Křemenný hranol
A celková vnitřní reflexe fluorescenční mikroskop (TIRFM) je typ mikroskop se kterou může být tenká oblast vzorku, obvykle menší než 200 nanometrů pozorováno.
Pozadí
v buňka a molekulární biologie, velký počet molekulární události v buněčných površích, jako je buněčná adheze, vazba buněk pomocí hormony, vylučování z neurotransmitery a dynamika membrány byly studovány konvenčními metodami fluorescenční mikroskopy. Nicméně, fluorofory které jsou vázány na povrch vzorku a ty v okolním médiu existují v rovnováha Stát. Když jsou tyto molekuly excitovány a detekovány běžným fluorescenčním mikroskopem, výsledná fluorescence z těchto fluoroforů vázaných na povrch je často přemožena fluorescencí pozadí kvůli mnohem větší populaci nevázaných molekul. TIRFM umožňuje selektivní excitaci povrchově vázaných fluoroforů, zatímco nevázané molekuly nejsou excitovány a nefluoreskují. Vzhledem k sub-mikronové povrchové selektivitě se TIRFM stala metodou volby pro detekci jedné molekuly.
Přehled
Myšlenka využití úplného vnitřního odrazu k osvětlení buněk kontaktujících povrch skla byla poprvé popsána E.J. Ambrose v roce 1956.[1] Tuto myšlenku poté rozšířil Daniel Axelrod[2] na University of Michigan, Ann Arbor na začátku 80. let jako TIRFM. TIRFM používá postupná vlna selektivně osvětlovat a vzrušovat fluorofory v omezené oblasti vzorku bezprostředně sousedící s rozhraním sklo-voda. Evanescent elektromagnetické pole se exponenciálně rozpadá z rozhraní, a tak proniká do hloubky pouze přibližně 100 nm do vzorkového média. TIRFM tedy umožňuje selektivní vizualizaci povrchových oblastí, jako jsou bazální plazmatická membrána (které jsou asi 7,5 nm silné) buněk, jak je znázorněno na obrázku výše. Všimněte si však, že vizualizovaná oblast je široká alespoň několik stovek nanometrů, takže cytoplazmatická zóna bezprostředně pod plazmatickou membránou je nutně vizualizována navíc k plazmatické membráně během TIRF mikroskopie. Selektivní vizualizace plazmatické membrány vykresluje vlastnosti a události na plazmatické membráně v živých buňkách s vysokou osou rozlišení.
TIRF lze také použít ke sledování fluorescence jedné molekuly,[3][4] což z něj dělá důležitý nástroj biofyzika a kvantitativní biologie. Mikroskopie TIRF byla také použita při detekci DNA biomarkerů s jednou molekulou a diskriminaci SNP. [5]
Ukázalo se, že Cis-geometrie (TIRFM prostřednictvím cíle) a trans-geometrie (TIRFM založené na hranolu a světlovodu) poskytují různou kvalitu účinku celkové vnitřní reflexe. V případě trans-geometrie jsou excitační světelná dráha a emisní kanál oddělené, zatímco v případě objektivového typu TIRFM sdílejí objektiv a další optické prvky mikroskopu. Ukázalo se, že hranolová geometrie generuje čistou evanescentní vlnu, jejíž exponenciální rozpad se blíží teoreticky předpovídané funkci.[6] V případě objektivně založeného TIRFM je však evanescentní vlna kontaminována intenzivní rozptýlené světlo. Ukázalo se, že intenzita rozptýleného světla představuje 10-15% evanescentní vlny, což ztěžuje interpretaci dat získaných pomocí objektivního typu TIRFM [7][8]
Reference
- ^ Ambrose, EJ (24. listopadu 1956). "Povrchový kontaktní mikroskop pro studium buněčných pohybů". Příroda. 178 (4543): 1194. Bibcode:1956 Natur.178.1194A. doi:10.1038 / 1781194a0. PMID 13387666. S2CID 4290898.
- ^ Axelrod, D. (1. dubna 1981). „Kontakty buňka-substrát osvětlené celkovou vnitřní reflexní fluorescencí“. The Journal of Cell Biology. 89 (1): 141–145. doi:10.1083 / jcb.89.1.141. PMC 2111781. PMID 7014571.
- ^ Yanagida, Toshio; Sako, Yasushi; Minoghchi, Shigeru (10. února 2000). „Jednomolekulární zobrazování signalizace EGFR na povrchu živých buněk“. Přírodní buněčná biologie. 2 (3): 168–172. doi:10.1038/35004044. PMID 10707088. S2CID 25515586.
- ^ Andre a kol. Křížově korelovaný tirf / afm odhaluje asymetrické rozložení hlav generujících sílu podél samostatně sestavených syntetických myosinových vláken. BiophysicalJournal, 96: 1952–1960, 2009.
- ^ Sapkota, K .; et al. (2019). „Jednostupňová detekce Femtomoles DNA na základě FRET“. Senzory. 19 (16): 3495. doi:10,3390 / s19163495. PMID 31405068.
- ^ Ambrose, W; et al. (1999). "Detekce jedné molekuly s celkovou vnitřní excitací odrazu: porovnání signálu od pozadí a celkového signálu v různých geometriích". Cytometrie. 36 (3): 224–31. doi:10.1002 / (sici) 1097-0320 (19990701) 36: 3 <224 :: aid-cyto12> 3.0.co; 2-j. PMID 10404972.
- ^ Mattheyses A. a Axelrod, D. (2006). "Přímé měření profilu evanescentního pole vytvořeného objektivním TIRF." J Biomed Opt. 11: 014006A. doi:10.1117/1.2161018. PMID 16526883.
- ^ Brunstein M, Teremetz M, Hérault K, Tourain C, Oheim, M. (2014). „Odstranění nechtěné excitace vzdáleného pole v objektivu TIRF. Část I.“ Biophys. J. 106 (5): 1020. Bibcode:2014BpJ ... 106.1020B. doi:10.1016 / j.bpj.2013.12.049. PMC 4026778. PMID 24606927.CS1 maint: více jmen: seznam autorů (odkaz)
- Axelrod, Daniel (1. listopadu 2001). „Fluorescenční mikroskopie s vnitřní reflexí v buněčné biologii“ (PDF). Provoz. 2 (11): 764–774. doi:10.1034 / j.1600-0854.2001.21104.x. hdl:2027.42/72779. PMID 11733042. S2CID 15202097.
externí odkazy
- Interaktivní databáze fluorescenčních barviv a filtrů Interaktivní fluorescenční barvivo a databáze filtrů Carl Zeiss.
- Mikroskopie TIRF: Úvod a aplikace Výukový program TIRF z mikroskopie U
- Mikroskopie TIRF: Přehled Výukový program TIRF z centra zdrojů pro mikroskopii Olympus
- Mikroskopy TIRFM společnosti Olympus komerční mikroskopické systémy TIRF
- Laserový laser Carl Zeiss TIRF 3 komerční mikroskopické systémy TIRF
- Mikroskopie TIRF založená na světlovodu a hranolu TIRF-Labs.com: Komerční TIRF mikroskopie a spektroskopie. Výběr geometrie TIRFM pro vaši aplikaci
- Mikroskopie TIRF FLIM Lambert Instruments TIRF - FLIM mikroskopie
- Schwartz Research Group, CU-Boulder Výzkumná skupina pro zobrazování jedné molekuly

