Lithium-vzduchová baterie - Lithium–air battery
Tento článek má několik problémů. Prosím pomozte vylepši to nebo diskutovat o těchto otázkách na internetu diskusní stránka. (Zjistěte, jak a kdy tyto zprávy ze šablony odebrat) (Zjistěte, jak a kdy odstranit tuto zprávu šablony)
|
| Specifická energie | 40,104,000 J /kg (teoretický) |
|---|---|
| Hustota energie | ? J /m³ |
| Měrný výkon | 11400 Ž /kg |
| Jmenovité napětí článku | 2.91 PROTI |
The lithium-vzduchová baterie (Li-vzduch) je kov-vzduch elektrochemický článek nebo baterie chemie, která používá oxidace z lithium na anoda a snížení z kyslík na katoda k vyvolání toku proudu.[1]
Párování lithia a okolního kyslíku může teoreticky vést k elektrochemickým článkům s nejvyšší možnou hodnotou specifická energie. Teoretická specifická energie nevodné Li-air baterie v nabitém stavu s Li2Ó2 produktu a bez hmotnosti kyslíku je ~ 40,1 MJ / kg. To je srovnatelné s teoretickou měrnou energií benzínu, ~ 46,8 MJ / kg. V praxi byly prokázány Li-air baterie se specifickou energií ~ 6,12 MJ / kg na úrovni článku. To je asi 5krát více než u reklamy lithium-iontová baterie, a je dostatečný pro najetí 2 000 kg EV na ~ 500 km (310 mil) na jedno nabití s použitím 60 kg baterií. Praktická síla a životní cyklus lithium-iontových baterií však vyžadují podstatná vylepšení, než si najdou mezeru na trhu.
K rozvoji komerční implementace je zapotřebí významného pokroku v elektrolytu.[2] Aktivní jsou čtyři přístupy: aprotický,[3][4][5] vodný,[6] pevné skupenství[7] a smíšené vodné – aprotické.[8]
Konkrétně kovové vzduchové baterie zinek-vzduch, jim byla věnována pozornost kvůli potenciálně vysokým energetickým hustotám. Teoretické specifické hustoty energie pro baterie typu kov-vzduch jsou vyšší než pro iontové metody. Lithium-vzduchové baterie mohou teoreticky dosáhnout 3840 mA · h / g.[9]
Hlavní hnací silou trhu s bateriemi je automobilový průmysl. Energetická hustota benzínu je přibližně 13 kW · h / kg, což odpovídá 1,7 kW · h / kg energie dodávané na kola po ztrátách. Teoreticky může lithium-vzduch dosáhnout 12 kW · h / kg (43,2 MJ / kg) bez kyslíkové hmoty. Při zohlednění hmotnosti celého akumulátoru (pouzdro, vzduchové kanály, lithiový substrát), zatímco samotný lithium je velmi lehký, je hustota energie podstatně nižší.[10]
Li-vzduchová baterie měla potenciálně 5–15krát větší kapacitu specifická energie a Li-ion baterie od roku 2016[Aktualizace].[11]
Dějiny
Původně byl navržen v 70. letech jako možný zdroj energie pro bateriová elektrická vozidla, a hybridní elektrická vozidla Li-vzduchové baterie znovu získaly vědecký zájem koncem první dekády dvacátých let v důsledku pokroku v roce věda o materiálech.
Ačkoli myšlenka lithium-vzduchové baterie existovala dlouho před rokem 1996,[12][13][14][15] poměr rizika k prospěchu byl vnímán jako příliš vysoký na to, aby bylo možné jej sledovat. Záporná (lithiová kovová) a kladná (vzduchová nebo kyslíková) elektroda jsou ve skutečnosti důvody, proč se dobíjecí lithium-kovové baterie na trh nedostaly v 70. letech (lithium-iontová baterie v mobilním zařízení používá LiC6- grafitová sloučenina na záporné elektrodě, ne kov lithia). Nicméně vzhledem k vnímanému nedostatku jiných alternativ k akumulátorům s vysokou specifickou energií a kvůli některým původně slibným výsledkům z akademických laboratoří,[12][13] v roce 2006 začal exponenciálně růst počet patentů i publikací ve volné doméně týkajících se lithium-kyslíkových (včetně Li-air) baterií.[16][13] Technické potíže, kterým však tyto baterie čelí, zejména doba nabíjení, citlivost na dusík a vodu, a [17] vnitřní špatná vodivost nabitého Li2Ó2 druhy jsou hlavními výzvami.[18]
Konstrukce a provoz

Obecně se lithiové ionty pohybují mezi anodou a katodou přes elektrolyt. Při výboji elektrony sledují vnější obvod, aby prováděly elektrickou práci, a lithiové ionty migrují na katodu. Během nabíjení se lithiové kovové desky uvolní na anodu Ó
2 na katodě.[19] Oba nevodné[20] (s Li2Ó2 nebo LiO2 jako vypouštěcí produkty) a vodný (LiOH jako vypouštěcí produkt) Li-O2 baterie byly zváženy.[21][22] Vodná baterie vyžaduje ochrannou vrstvu na záporné elektrodě, aby kovový Li nereagoval s vodou.

Anoda
Typickou volbou anody je lithný kov. Na anodě elektrochemický potenciál nutí kov lithia, aby uvolňoval elektrony oxidace (bez zapojení katodického kyslíku). Poloviční reakce je:[23]
- Li ⇌ Li+ + e−
Lithium má vysokou specifickou kapacitu (3840 mAh / g) ve srovnání s jinými materiály baterie typu kov-vzduch (820 mAh / g pro zinek, 2965 mAh / g pro hliník ).[24] Na tyto články má vliv několik problémů. Hlavní výzvou při vývoji anod je zabránění anodě reagovat s elektrolytem. Alternativy zahrnují nové elektrolytické materiály nebo přepracování rozhraní mezi elektrolytem a anodou. Riziko lithiových anod dendritický lithiové usazeniny, snižování energetické kapacity nebo spouštění a zkrat.[25]Účinky velikosti pórů a distribuce velikosti pórů zůstávají špatně pochopeny.[24]
Při nabíjení / vybíjení v aprotických článcích se na anodu vysráží vrstvy solí lithia, které ji nakonec zakryjí a vytvoří bariéru mezi lithiem a elektrolytem. Tato bariéra zpočátku brání korozi, ale nakonec inhibuje kinetiku reakce mezi anodou a elektrolytem.[26] Tato chemická změna rozhraní pevná látka-elektrolyt (SEI) má za následek různé chemické složení na povrchu, což způsobí odpovídající změnu proudu. Nerovnoměrné rozdělení proudu dále rozvětvuje dendrit růst a obvykle vede ke zkratu mezi anodou a katodou.[27]
Ve vodných buňkách problémy na SEI pramení z vysoké reaktivity kovového lithia s vodou.[28]
Několik přístupů se pokouší tyto problémy překonat:
- Vytvoření ochranné vrstvy Li-ion pomocí di- a tribloku kopolymer elektrolyty.[29] Podle Seeo, Inc.,[29] takové elektrolyty (např. polystyren s vysokou Li-ion vodivostí segmentu měkkého polymeru, jako je směs poly (ethylenoxidu (PEO) a Li-soli)) kombinují mechanickou stabilitu segmentu tvrdého polymeru s vysokou iontovou vodivostí měkkého polymeru - lithia - solná směs. Tvrdost potlačuje dendritické šortky mechanickým blokováním.
- Li-ion vodivé sklo nebo sklokeramické materiály[7][30][31] jsou (obecně) snadno redukovány lithiovým kovem, a proto tenký film stabilního lithiového vodivého materiálu, jako je Li
3P nebo Li
3N, lze vložit mezi keramiku a kov. Tento keramický SEI inhibuje tvorbu dendritů a chrání lithiový kov před atmosférickou kontaminací.
Katoda
Na katodě během nabíjení kyslík předává elektrony lithiu redukcí. Mezoporézní uhlík byl použit jako katodový substrát s kovovými katalyzátory[32] které zvyšují kinetiku redukce a zvyšují specifickou kapacitu katody.[11] Mangan, kobalt, ruthenium, platina, stříbro nebo směs kobaltu a manganu jsou potenciálními kovovými katalyzátory. Za určitých okolností si katody katalyzované manganem vedly nejlépe, se specifickou kapacitou 3137 mA · H / g uhlíku a kobaltem katalyzované katody fungovaly jako druhé nejlepší, se specifickou kapacitou 2414 mA · H / g uhlíku.[33] Na základě prvního modelování lithium-vzduchových baterií v měřítku pórů mikrostruktura katody významně ovlivňuje kapacitu baterie jak v režimu blokování pórů, tak v režimu blokování pórů.[34]
Většina limitů Li-air baterie je na katodě, což je také zdrojem jejích potenciálních výhod. Na katodě musí být přítomen atmosférický kyslík, ale nečistoty, jako je vodní pára, ji mohou poškodit.[4]Neúplný výboj v důsledku zablokování porézní uhlíkové katody výbojovými produkty, jako je např peroxid lithný (v aprotických vzorech) je nejvážnější.
Katalyzátory prokázaly slib při vytváření preferenční nukleace Li
2Ó
2 přes Li
2Ó, což je u lithia nevratné.[35]
Výkon Li-vzduch je omezen účinností reakce na katodě, protože většina z pokles napětí dochází tam.[24] Bylo posouzeno několik chemických postupů, které se vyznačují elektrolytem. Tato diskuse se zaměřuje na aprotické a vodné elektrolyty, protože elektrochemie v pevné fázi není dostatečně známa.
V buňce s aprotický elektrolyt oxidy lithia se vyrábějí redukcí na katodě:
- Li+ + e− +Ó
2 + * → LiO
2* - Li+ + e− +LiO
2* →Li
2Ó
2*
kde "*" označuje povrchovou stránku na Li
2Ó
2 kde roste růst, což je v podstatě neutrální volné místo Li v EU Li
2Ó
2 povrch.
Oxidy lithia jsou nerozpustné v aprotických elektrolytech, což vede k ucpání katody.[36]
A MnO
2 nanodrátová katoda rozšířená geneticky modifikovanou M13 bakteriofág Virus nabízí dvojnásobnou až trojnásobnou hustotu energie lithium-iontových baterií z roku 2015. Virus zvětšil velikost pole nanodrátů, které je kolem 80 nm. Výsledné dráty měly špičatý povrch. Hroty vytvářejí větší povrchovou plochu pro hostitelská reakční místa. Virový proces vytváří zesítěnou 3D strukturu, spíše než izolované dráty, stabilizující elektrodu. Virový proces je na vodní bázi a probíhá při pokojové teplotě.[37][38]
Elektrolyt
Úsilí v Li-air bateriích se zaměřilo na čtyři elektrolyty: vodné kyselé, vodné alkalické, nevodné protické a aprotické.
V buňce s vodný elektrolyt redukce na katodě může také produkovat hydroxid lithný:
Vodný
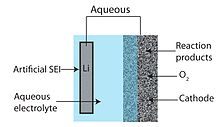
An vodný Li-air baterie se skládá z lithiové kovové anody, vodného elektrolytu a porézní uhlíkové katody. Vodný elektrolyt kombinuje lithné soli rozpuštěné ve vodě. Zabraňuje ucpávání katody, protože reakční produkty jsou rozpustné ve vodě.[6] Vodný design má vyšší praktický výbojový potenciál než jeho aprotický protějšek. Kov lithia však prudce reaguje s vodou, a proto vodná konstrukce vyžaduje pevné rozhraní elektrolytu mezi lithiem a elektrolytem. Obvykle se používá lithium-vodivá keramika nebo sklo, ale vodivost je obecně nízká (řádově 10−3 S / cm při okolních teplotách).[28]
Kyselý elektrolyt
- 2Li + ½ Ó
2 + 2H+ → 2Li++ H
2Ó
Konjugovaná báze je zapojena do reakce. Teoretická maximální specifická energie a hustota energie článku Li-vzduch jsou 1400 W · h / kg a 1680 W · h / l.[10]
Alkalický vodný elektrolyt
- 2Li + ½ Ó
2 + H
2Ó → 2 LiOH
Molekuly vody se účastní redoxních reakcí na vzduchové katodě. Teoretická maximální specifická energie a hustota energie článku Li-vzduch jsou 1300 W · h / kg, respektive 1520 W · h / l.[10]
Nové katodové materiály musí odpovídat za uložení podstatného množství LiO
2, Li
2Ó
2 a / nebo LiOH, aniž by došlo k zablokování pórů katody a použití vhodných katalyzátorů, aby byly elektrochemické reakce energeticky praktické.
- Systémové materiály se dvěma póry nabízejí nejslibnější energetickou kapacitu.[39]
- První systém pórů slouží jako sklad oxidačních produktů.
- Druhý pórový systém slouží jako transport kyslíku.
Aprotické

Nejprve byly předvedeny nevodné Li-vzduchové baterie.[40] Obvykle používají smíšené ethylenkarbonát + propylenkarbonát rozpouštědla s LiPF6 nebo Li-bis-sulfonimidové soli, jako jsou běžné lithium-iontové baterie, avšak spíše s gelovým než kapalným elektrolytem.[41] Rozdíl napětí při nabíjení a vybíjení konstantním proudem je obvykle mezi 1,3 a 1,8 V (s OCP asi 4,2 V) i při tak směšně nízkých proudech, jako je 0,01–0,5 mA / cm² a 50–500 mA / g C na kladná elektroda (viz obrázek 2),[42][43][44] Uhličitanová rozpouštědla se však odpařují a oxidují kvůli vysokému přepětí po nabití.[45] Uvažována byla i jiná rozpouštědla, jako jsou glymy s uzavřeným koncem, DMSO, dimethylacetamid a iontové kapaliny.[46][47] Uhlíková katoda se během nabíjení oxiduje nad +3,5 V v Li a vytváří Li2CO3, což vede k nevratné ztrátě kapacity.[47]
Největší úsilí aprotický materiály, které se skládají z lithiové kovové anody, kapaliny organický elektrolyt a porézní uhlíková katoda.[3] Elektrolyt může být vyroben z jakékoli organické kapaliny schopné solvatovat lithné soli, jako je LiPF
6, LiAsF
6, LiN (SO
2CF
3)
2, a LiSO
3CF
3), ale obvykle se skládal z uhličitany, ethery a estery.[3][19] Uhlíková katoda je obvykle vyrobena z uhlíkového materiálu o vysoké ploše s nanostrukturou oxid kovu katalyzátor (běžně MnO
2 nebo Mn
3Ó
4). Hlavní výhodou je spontánní vytvoření bariéry mezi anodou a elektrolytem (analogicky k bariéře vytvořené mezi elektrolytem a uhlík-lithiovými anodami v konvenčních lithium-iontových bateriích), která chrání kov lithia před další reakcí s elektrolytem. I když je dobíjecí,[10] the Li
2Ó
2 produkovaný na katodě je obecně nerozpustný v organickém elektrolytu, což vede k hromadění podél rozhraní katoda / elektrolyt. Díky tomu jsou katody v aprotických bateriích náchylné k ucpávání a rozšiřování objemu, což postupně snižuje vodivost a zhoršuje výkon baterie.[6][28][48] Dalším problémem je, že organické elektrolyty jsou hořlavé a mohou se vznítit, pokud je článek poškozen.[7]
Ačkoli většina studií souhlasí Li
2Ó
2 je konečný produkt vypouštění nevodného Li-O2 baterie, značné důkazy, že jeho tvorba neprobíhá jako přímá 2-elektronová elektroredukce na peroxid O2−
2 (což je společná cesta pro O2 redukce vody na uhlíku), ale spíše prostřednictvím redukce jednoho elektronu na superoxid O−
2, následovaná jeho disproporcí:
- 2LiO
2 ⇌ Li
2Ó
2+ O.
2(1)
Superoxid (Ó−
2) byl tradičně považován za nebezpečný meziprodukt v aprotických kyslíkových bateriích kvůli jeho vysokému obsahu nukleofilita, zásaditost a redox potenciál[49][50] Nicméně zprávy[51][52] naznačují, že LiO2 je meziproduktem během vypouštění na peroxid (Li
2Ó
2) a lze jej použít jako konečný produkt vybíjení, potenciálně se zlepšenou životností cyklu, i když s nižší měrnou energií (o něco větší hmotností baterie). Bylo skutečně prokázáno, že za určitých podmínek může být superoxid stabilní při teplotě místnosti 20–70 hodin.[51] Nevratná ztráta kapacity při disproporcionaci LiO2 v nabité baterii nebyl vyřešen.
Pt / C se zdá být nejlepším elektrokatalyzátorem pro O2 evoluce a Au / C pro O2 snížení, když Li
2Ó
2 je produkt.[53] „Výkon nabíjecích lithium-vzduchových baterií s nevodnými elektrolyty je však omezen reakcemi na kyslíkové elektrodě, zejména O2 vývoj. Konvenční porézní uhlíkové vzduchové elektrody nejsou schopné poskytovat mAh / ga mAh / cm2 kapacity a rychlosti vybíjení na velikosti požadované pro baterie s opravdu vysokou hustotou energie pro aplikace EV. “[53] Kapacita (v mAh / cm2) a životnost cyklu nevodného Li-O2 baterie je omezena ukládáním nerozpustných a špatně elektronicky vodivých fází LiOx po vybití.[49] (Li
3Ó
4 Předpokládá se, že bude mít lepší vodivost Li + než LiO2 a Li
2Ó
2 fází).[54] To činí praktickou specifickou energii Li-O2 baterie výrazně menší, než předpovídá výpočet na úrovni činidla. Zdá se, že tyto parametry dosáhly svých limitů a další zlepšení se očekává pouze u alternativních metod.
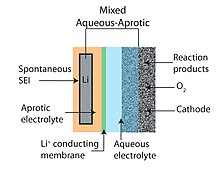
Smíšený vodný - aprotický
Konstrukce vodně-aprotické nebo smíšené Li-vzduchové baterie se pokouší spojit výhody konstrukcí aprotické a vodné baterie. Společným rysem hybridních konstrukcí je dvoudílný (jeden díl vodného a jeden díl aprotického) elektrolytu spojeného lithium-vodivým membrána. Anoda dosedá na aprotickou stranu, zatímco katoda je v kontaktu s vodnou stranou. Jako membrána spojující dva elektrolyty se obvykle používá lithium-vodivá keramika.[6][10]
Použití pevného elektrolytu (viz obr. 3) je jedním z takových alternativních přístupů, které umožňují kombinaci anody lithium-kov s vodnou katodou.[55] Keramické pevné elektrolyty (CSE) rodiny NASICON (např. Li1 − xAXM2 − x(PO4)3 s A ∈ [Al, Sc, Y] a M ∈ [Ti, Ge]) byly studovány. Kompatibilní s vodou při alkalickém pH a s velkým elektrochemickým oknem (viz obr. 3,4), jejich nízkou vodivostí Li + iontů při pokojové teplotě (<0,005 S / cm,> 85 Ω cm2)[47] činí je nevhodnými pro automobilové a stacionární aplikace pro skladování energie, které vyžadují nízké náklady (tj. hustoty provozního proudu nad 100 mA / cm2). Dále jsou Ti i Ge redukovány kovovým Li a je nutná mezivrstva mezi keramickou elektrodou a zápornou elektrodou. Naproti tomu pevné polymerní elektrolyty (SPE) mohou poskytovat vyšší vodivost na úkor rychlejšího křížení vody a jiných malých molekul, které reagují na kovový Li. Mezi exotičtější membrány považované za Li-O2 baterie je monokrystalický křemík.[45]
V roce 2015 vědci oznámili design, který používal vysoce porézní grafen pro anodu elektrolyt lithium bis (trifluormethyl) sulfonylimid / dimethoxyethan s přidanou vodou a jodid lithný pro použití jako „prostředník“. Produkuje elektrolyt hydroxid lithný (LiOH) na katodě místo peroxid lithný (Li
2Ó
2). Výsledek nabídl energetickou účinnost 93 procent (napěťová mezera 0,2) a cykloval více než 2 000krát s malým dopadem na výkon.[56][57] Návrh však vyžadoval spíše čistý kyslík než okolní vzduch.[58]

Pevné skupenství
A pevné skupenství design baterie je atraktivní pro svou bezpečnost, což eliminuje možnost prasknutí zapalování.[7] Současné polovodičové Li-vzduchové baterie používají lithiovou anodu, keramický, skleněný nebo sklokeramický elektrolyt a porézní uhlíkovou katodu. Anoda a katoda jsou obvykle odděleny od elektrolytu polymer-keramickými kompozity, které zvyšují přenos náboje na anodě a elektrochemicky spojují katodu s elektrolytem. Polymer-keramické kompozity snižují celkovou impedanci. Hlavní nevýhodou konstrukce baterie v pevném stavu je nízká vodivost většiny sklokeramických elektrolytů. Iontová vodivost současného lithia rychlé iontové vodiče je nižší než alternativy kapalného elektrolytu.[9]
Výzvy
Od roku 2013 designéři čelili mnoha výzvám.
Katoda
Většina limitů Li-air baterie je na katodě, což je také zdrojem jejích potenciálních výhod. Neúplný výboj v důsledku zablokování porézní uhlíkové katody výbojovými produkty, jako je např peroxid lithný (v aprotických vzorech) je nejvážnější. Bylo modelováno několik způsobů sraženin.[59] Parametr Da byl definován pro měření změn teploty, koncentrace druhů a potenciálů.[60][61]
Účinky velikosti pórů a distribuce velikosti pórů zůstávají špatně pochopeny.[24]
Katalyzátory prokázaly slib při vytváření preferenční nukleace Li
2Ó
2 přes Li
2Ó, což je u lithia nevratné.[35]
Na katodě musí být přítomen atmosférický kyslík, ale nečistoty, jako je vodní pára, ji mohou poškodit.[4]
Elektrochemie
V roce 2017 návrhy buněk, poplatek nadměrný potenciál je mnohem vyšší než nadměrný potenciál vybíjení. Značný nadměrný náboj naznačuje přítomnost sekundárních reakcí.[62] Elektrická účinnost je tedy pouze kolem 65%.[24]
Katalyzátory jako MnO
2, Co, Pt a Au mohou potenciálně snížit nadměrné potenciály, ale účinek je špatně pochopen.[35] Několik katalyzátory zejména zlepšit výkon katody MnO
2, a mechanismus vylepšení je známý jako povrchový kyslík redox poskytující bohatá počáteční místa růstu pro peroxid lithný.[63] Uvádí se také, že katalyzátory mohou změnit strukturu oxidových usazenin.[64][65]
Významným poklesem kapacity buněk se zvyšující se rychlostí vybíjení je další problém. Snížení kapacity buněk je přičítáno limitům přenosu kinetického náboje.[24] Jelikož anodická reakce probíhá velmi rychle, předpokládá se, že meze přenosu náboje nastávají na katodě.
Stabilita
Dlouhodobý provoz na baterii vyžaduje chemickou stabilitu všech součástí článku. Současné konstrukce článků vykazují špatnou odolnost vůči oxidaci reakčními produkty a meziprodukty. Mnoho vodných elektrolytů je těkavých a mohou se v průběhu času odpařovat.[24] Stabilitu obecně brzdí parazitické chemické reakce, například reakce reaktivní kyslík.[66][67]
Aplikace
Vozidla
Li-vzduchové články jsou zajímavé pro elektrická vozidla kvůli jejich vysoké teoretické specifické a objemové hustotě energie, srovnatelné s benzín. Elektrické motory poskytují vysokou účinnost (95% ve srovnání s 35% pro spalovací motor ). Li-vzduchové články mohly nabídnout dojezd ekvivalentní dnešním vozidlům s akumulátorem o třetinu velikosti standardních palivových nádrží za předpokladu, že rovnováha závodu potřebného pro údržbu akumulátoru byla zanedbatelná hmotnost nebo objem.[Citace je zapotřebí ]
Záloha mřížky
V roce 2014 vědci oznámili hybridní solární baterii. Cestou do a nabíjením baterie se ztrácí až 20% energie vyrobené konvenčními solárními články. Hybrid uchovává téměř 100% vyrobené energie. Jedna verze hybridu používala a lithium-iontová baterie pomocí draslíku a vzduchu. Nabízel vyšší hustotu energie než konvenční lithium-iontové baterie, stál méně a vyhnul se toxickým vedlejším produktům. Nejnovější zařízení v podstatě nahradilo lithium draslíkem.[68]
Solární článek používal pletivo vyrobené z mikroskopických tyčí z oxid titaničitý aby umožnil průchod potřebného kyslíku. Zachycené sluneční světlo produkovalo elektrony, které se rozkládaly peroxid lithný do lithiových iontů, čímž se nabije baterie. Během výboje kyslík ze vzduchu doplnil peroxid lithný.[68]
Viz také
Reference
- ^ Badwal, Sukhvinder P. S .; Giddey, Sarbjit S .; Munnings, Christopher; Bhatt, Anand I .; Hollenkamp, Anthony F. (24. září 2014). „Rozvíjející se technologie elektrochemické přeměny a skladování energie“. Hranice v chemii. 2: 79. Bibcode:2014FrCh .... 2 ... 79B. doi:10.3389 / fchem.2014.00079. PMC 4174133. PMID 25309898.
- ^ Christensen, J .; Albertus, P .; Sanchez-Carrera, R. S .; Lohmann, T .; Kozinsky, B .; Liedtke, R .; Ahmed, J .; Kojic, A. (2012). „Kritický přehled Li-Air baterií“. Journal of the Electrochemical Society. 159 (2): R1. doi:10.1149 / 2.086202jes.
- ^ A b C Younesi, Reza; Veith, Gabriel M .; Johansson, Patrik; Edström, Kristina; Vegge, Tejs (2015). „Lithiové soli pro pokročilé lithiové baterie: Li-metal, Li – O 2 a Li – S“. Energetické prostředí. Sci. 8 (7): 1905–1922. doi:10.1039 / c5ee01215e.
- ^ A b C Ogasawara, T .; Débart, A. L .; Holzapfel, M .; Novák, P .; Bruce, P. G. (2006). "Dobíjecí Li2O2Elektroda pro lithiové baterie". Journal of the American Chemical Society. 128 (4): 1390–1393. doi:10.1021 / ja056811q. PMID 16433559.
- ^ Debart, A; Bao, J; et al. (2008). „α-MnO
2 Nanodráty: katalyzátor proÓ
2 Elektroda v dobíjecích lithiových bateriích “. Angew. Chem. 47 (24): 4521–4524. doi:10.1002 / anie.200705648. PMID 18461594. - ^ A b C d On, P .; Wang, Y .; Zhou, H. (2010). „Li-air palivový článek s recyklovaným vodným elektrolytem pro lepší stabilitu“. Elektrochemická komunikace. 12 (12): 1686–1689. doi:10.1016 / j.elecom.2010.09.025.
- ^ A b C d Kumar, B .; Kumar, J .; Leese, R .; Fellner, J. P .; Rodrigues, S. J .; Abraham, K. M. (2010). „Polovodičová dobíjecí lithium-vzduchová baterie s dlouhou životností“. Journal of the Electrochemical Society. 157: A50. doi:10.1149/1.3256129.
- ^ Wang, Yonggang (2010). „Lithium-vzduchová baterie s potenciálem nepřetržitého snižování O2 ze vzduchu pro dodávání energie“. Journal of Power Sources. 195 (1): 358–361. doi:10.1016 / j.jpowsour.2009.06.109.
- ^ A b Kumar, B .; Kumar, J. (2010). „Katody pro lithium-kyslíkové články v pevné fázi: role sklokeramiky Nasicon“. Journal of the Electrochemical Society. 157 (5): A611. doi:10.1149/1.3356988.
- ^ A b C d E Girishkumar, G .; McCloskey, B .; Luntz, A. C .; Swanson, S .; Wilcke, W. (2010). „Lithium-Air Battery: Promise and Challenges“. The Journal of Physical Chemistry Letters. 1 (14): 2193–2203. doi:10.1021 / jz1005384.
- ^ A b Vyd. Jurgen O. Besenhard, Příručka o bateriových materiálech, New Your, Wiley-VCH, 1999, ISBN 3-527-29469-4.
- ^ A b Abraham a Jiang 1996
- ^ A b C Lu a Amine 2013
- ^ Balaish, Kraytsberg a kol. 2014
- ^ Lu, Li a kol. 2014
- ^ Ogasawara, Débart a kol. 2006
- ^ Lee, Roev a kol. 2015
- ^ Gallagher, KG; Goebel, S; Greszler, T; Mathias, M .; Oelerich, W; Eroglu, D. (2014). „Kvantifikace příslibu lithium-vzduchových baterií pro elektrická vozidla“. Energetická a environmentální věda. 7 (5): 1555–1563. doi:10.1039 / C3EE43870H.
- ^ A b Xu, K. (2004). „Nevodné kapalné elektrolyty pro dobíjecí baterie na bázi lithia“. Chemické recenze. 104 (10): 4303–417. doi:10,1021 / cr030203g. PMID 15669157.
- ^ McCloskey, Burke a kol. 2015
- ^ Balaish, Kraytsberg a kol. 2014
- ^ Imanishi a Yamamoto 2014
- ^ Winter, M .; Brodd, R. J. (2004). „Co jsou baterie, palivové články a superkondenzátory?“. Chemické recenze. 104 (10): 4245–4269. doi:10.1021 / cr020730k. PMID 15669155.
- ^ A b C d E F G Kraytsberg, A .; Ein-Eli, Y. (2011). „Recenze Li-air baterií - příležitosti, omezení a perspektiva“. Journal of Power Sources. 196 (3): 886–893. Bibcode:2011JPS ... 196..886K. doi:10.1016 / j.jpowsour.2010.09.031.
- ^ Tikekar, Mukul D .; Choudhury, Snehashis; Tu, Zhengyuan; Archer, Lynden A. (08.09.2016). "Principy návrhu elektrolytů a rozhraní pro stabilní lithium-kovové baterie". Přírodní energie. 1 (9): 16114. Bibcode:2016NatEn ... 116114T. doi:10.1038 / nenergy.2016.114. ISSN 2058-7546.
- ^ Aurbach, D. (2000). "Přehled vybraných interakcí elektrod a roztoků, které určují výkon Li a Li iontových baterií". Journal of Power Sources. 89 (2): 206–218. Bibcode:2000JPS .... 89..206A. doi:10.1016 / S0378-7753 (00) 00431-6.
- ^ Whittingham, M. S. (1976). "Skladování elektrické energie a chemie interkalace". Věda. 192 (4244): 1126–1127. Bibcode:1976Sci ... 192.1126W. doi:10.1126 / science.192.4244.1126. PMID 17748676.
- ^ A b C Kowalczk, I .; Read, J .; Salomon, M. (2007). „Li-air baterie: Klasický příklad omezení z důvodu rozpustnosti“. Čistá a aplikovaná chemie. 79 (5): 851. doi:10.1351 / pac200779050851.
- ^ A b Singh, M .; Gur, I .; Balsara, N. P. (2009). "Materiál pevného elektrolytu vyrobitelný metodami zpracování polymerů", Patentová přihláška USA #12271829.
- ^ Bates, J. (2000). „Tenkovrstvé lithiové a lithium-iontové baterie“. Ionika v pevné fázi (Vložený rukopis). 135 (1–4): 33–37. doi:10.1016 / S0167-2738 (00) 00327-1.
- ^ Visco, S .; Nimonm, Y. (2010). "Aktivní kov / vodné elektrochemické články a systémy", USA Patent #7645543.
- ^ Nová energie a palivo. 2011. Zpřístupněno 20. listopadu 2011
- ^ Abraham, K. M. (1996). „Polymerní elektrolytová dobíjecí lithiová / kyslíková baterie“. Journal of the Electrochemical Society. 143: 1–5. doi:10.1149/1.1836378.
- ^ Andersen, Charles P .; Hu, Han; Qiu, Gang; Kalra, Vibha; Sun, Ying (2015). „Model vyřešený transportem v póru zahrnující katodovou mikrostrukturu a růst peroxidu v lithium-vzduchových bateriích“. J. Electrochem. Soc. 162: A1135 – A1145. doi:10.1149 / 2.0051507jes.
- ^ A b C Lu, Yi-Chun (2010). „Vliv katalyzátorů na vybíjecí a nabíjecí napětí dobíjecích lithium-kyslíkových baterií“. Elektrochemické a pevné dopisy. 13 (6): A69. doi:10.1149/1.3363047. hdl:1721.1/79694.
- ^ Přečtěte si, J. (2002). "Charakterizace lithiové / kyslíkové baterie s organickým elektrolytem". Journal of the Electrochemical Society. 149 (9): A1190 – A1196. doi:10.1149/1.1498256.
- ^ „Lithium-vzduchové baterie se stávají virálními pro větší odolnost a výkon“. gizmag.com.
- ^ Oh, D .; Qi, J .; Lu, Y. C .; Zhang, Y .; Shao-Horn, Y .; Belcher, A. M. (2013). „Biologicky vylepšený design katody pro lepší kapacitu a životnost lithium-kyslíkových baterií“. Příroda komunikace. 4: 2756. Bibcode:2013NatCo ... 4,2756O. doi:10.1038 / ncomms3756. PMC 3930201. PMID 24220635.
- ^ Williford, R. E.; Zhang, J. G. (2009). „Konstrukce vzduchové elektrody pro trvalý vysoký výkon Li / air baterií“. Journal of Power Sources. 194 (2): 1164–1170. Bibcode:2009JPS ... 194.1164W. doi:10.1016 / j.jpowsour.2009.06.005.
- ^ Abraham a Jiang 1996.
- ^ Imanishi, Matsui a kol. 2014
- ^ Balaish, Kraytsberg a kol. 2014.
- ^ McCloskey, Burke a kol. 2015.
- ^ Liu, Xu a kol. 2016.
- ^ A b Lu & Amine 2013.
- ^ Balaish & Kraytsberg et al. 2014.
- ^ A b C Imanishi, Matsui a kol. 2014.
- ^ Li, Xianglin; Faghri, Amir (2012). „Optimalizace katodové struktury lithium-vzduchových baterií na základě dvourozměrného, přechodného, neizotermického modelu“. Journal of the Electrochemical Society. 159 (10): A1747 – A1754. doi:10.1149 / 2.043210jes.
- ^ A b Balaish, Kraytsberg a kol. 2014.
- ^ McCloskey, Burke a kol. 2015.
- ^ A b Zhai, Lau a kol. 2015.
- ^ Lu, Lee a kol. 2016.
- ^ A b Lu, Xu a kol. 2010.
- ^ Shi, Xu a kol. 2015.
- ^ Visco 2004.
- ^ Delacey, Lynda (19. listopadu 2015). „Více překážek naskočilo na cestu k praktické lithium-vzduchové baterii“. www.gizmag.com. Citováno 2015-12-03.
- ^ Liu, Tao; Leskes, Michal; Yu, Wanjing; Moore, Amy J .; Zhou, Lina; Bayley, Paul M .; Kim, Gunwoo; Gray, Clare P. (2015-10-30). "Cyklování baterií Li-O2 prostřednictvím tvorby a rozkladu LiOH". Věda. 350 (6260): 530–533. arXiv:1805.03042. doi:10.1126 / science.aac7730. ISSN 0036-8075. PMID 26516278.
- ^ „Nový design ukazuje cestu k„ konečné “baterii“. phys.org. 29. října 2015. Citováno 2015-12-03.
- ^ Y. Wang, Modelování tvorby výboje a její vliv na výkon lithium-vzduchových baterií, Electrochimica Acta 75 (2012) 239–246.
- ^ Y. Wang a S. C. Cho, Analysis of Air Cathode Performance for Lithium-air Batteries, Journal of the Electrochemical Society, 160 (10) A1-A9 (2013).
- ^ Y. Wang, Z. Wang, H. Yuan a T. Li, skladovací kapacita a ztráta napětí v baterii Li-air, Electrochimica Acta, 180 (2015) 382–393
- ^ Zhang, T .; Imanishi, N .; Shimonishi, Y .; Hirano, A .; Takeda, Y .; Yamamoto, O .; Sammes, N. (2010). „Nová dobíjecí lithium / vzduchová baterie s vysokou hustotou energie“. Chemická komunikace (Vložený rukopis). 46 (10): 1661–1663. doi:10.1039 / b920012f. PMID 20177608.
- ^ Zheng, Yongping; Song, Kyeongse; Jung, Jaepyeong; Li, Chenzhe; Heo, Yoon-Uk; Park, Min-Sik; Cho, Maenghyo; Kang, Yong-Mook; Cho, Kyeongjae (květen 2015). „Kritický deskriptor pro racionální návrh katalyzátorů na bázi oxidu v dobíjecích Li-O bateriích: povrchová hustota kyslíku“. Chemie materiálů. 27 (9): 3243–3249. doi:10.1021 / acs.chemmater.5b00056.
- ^ Darren Quick (5. dubna 2010). „Lithium-vzduchové baterie nabízejí trojnásobnou hustotu energie“. Citováno 5. října 2011.
- ^ Shimonishi, Y .; Zhang, T .; Imanishi, N .; Im, D .; Lee, D. J .; Hirano, A .; Takeda, Y .; Yamamoto, O .; Sammes, N. (2011). „Studie sekundárních lithium-vzduchových baterií - Stabilita lithium-iontového vodivého pevného elektrolytu typu NASICON v alkalických vodných roztocích.“ Journal of Power Sources. 196 (11): 5128–5132. Bibcode:2011JPS ... 196.5128S. doi:10.1016 / j.jpowsour.2011.02.023.
- ^ Yao, Xiahui; Dong, Qi; Cheng, Qingmei; Wang, Dunwei (2016). „Proč selhávají lithium-kyslíkové baterie: Parazitické chemické reakce a jejich synergický účinek“. Angewandte Chemie International Edition. 55: 11344–11353. doi:10,1002 / anie.201601783.
- ^ Tvorba singletového kyslíku během procesu nabíjení aprotické lithium-kyslíkové baterie J. Wandt, P. Jakes, J. Granwehr, H.A. Gasteiger, R.-A. Eichel, Angew. Chem. Int. Vyd. 2016, 128, 7006–7009. {{doi: 10.1002 / anie.201602142}}
- ^ A b Dimberuon, Peniel M. (28. října 2014). „Nová hybridní solární baterie má za cíl problém se skladováním energie solární energie“. Centrum singularity. Citováno 17. prosince 2016.
externí odkazy
- Argonne otevírá kapitolu výzkumu baterií - lithiový vzduch
- Argonne pokročilý výzkum v oblasti baterie, který se snaží vytlačit benzín
- Projekt IBM Battery 500
- Výrobce baterií PolyPlus
- Lithion, Inc. Design lithium-vzduchové baterie
- Chemici dělají průlom na cestě k vytvoření dobíjecí lithium-kyslíkové baterie, University of Waterloo
- Kvazi-pevnolátková dobíjecí lithium-kyslíková baterie na základě a gel polymer elektrolyt s iontovou kapalinou.

