Zinek – cerová baterie - Zinc–cerium battery - Wikipedia
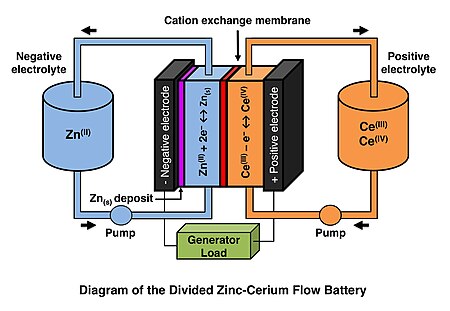
Zinek – cerové baterie jsou typem redox průtoková baterie poprvé vyvinuta společností Plurion Inc. (UK) během 2000.[1][2] V tomhle dobíjecí baterie, oba negativní zinek a pozitivní cer elektrolyty cirkulují elektrochemickým průtokovým reaktorem během provozu a skladují se ve dvou oddělených zásobnících. Negativní a pozitivní elektrolytové oddíly v elektrochemickém reaktoru jsou odděleny katexovou membránou, obvykle Nafion (DuPont ). Redoxní reakce Ce (III) / Ce (IV) a Zn (II) / Zn probíhají na kladné a záporné elektrodě. Protože zinek je galvanicky pokoveno během nabíjení na záporné elektrodě je tento systém klasifikován jako hybridní průtoková baterie. Na rozdíl od v zinek – brom a zinek-chlor redoxní průtokové baterie, k rozpuštění halogenových plynů není potřeba žádné kondenzační zařízení. Činidla používaná v systému zinek-cer jsou podstatně levnější než činidla používaná ve vanadové průtokové baterii.
Vzhledem k vysokému standardnímu potenciálu elektrod jak u oxidů zinku, tak u oxidu ceričitého ve vodném prostředí je napětí článku otevřeného obvodu až 2,43 V.[1] Mezi další navrhované dobíjecí vodné průtoková baterie Tento systém má největší napětí článků a jeho hustota výkonu na plochu elektrody je na druhém místě za průtokovou baterií H2-Br2.[3] Kyselina methansulfonová se používá jako podpůrný elektrolyt, protože umožňuje vysoké koncentrace jak zinku, tak ceru; rozpustnost odpovídajících methansulfonátů je 2,1 M pro Zn,[4] 2,4 M pro Ce (III) a až 1,0 M pro Ce (IV).[5] Kyselina methansulfonová je zvláště vhodná pro průmyslové elektrochemické aplikace a je považována za zelenou alternativu k jiným nosným elektrolytům.[4]
Průtoková baterie Zn-Ce je stále v raných fázích vývoje. Hlavní technologickou výzvou je kontrola neúčinnosti a samovybíjení (koroze Zn vývojem vodíku) na záporné elektrodě. Z komerčního hlediska potřeba drahých Pt-Ti elektrod zvyšuje kapitálové náklady systému ve srovnání s jinými RFB.
Chemie buněk
Na záporné elektrodě (anodě) je zinek galvanicky pokovován a stripován na uhlíkových polymerních elektrodách během nabíjení, respektive výboje.[6][7][8]
- Zn2+(aq) + 2e− ⇌ Zn(s)
- (-0,76 V vs. ONA)
Na kladné elektrodě (katodě) (materiály na bázi titanu nebo uhlíková plstěná elektroda) probíhá během nabíjení a výboje oxidace Ce (III) a redukce Ce (IV).[9][10]
- Ce4+(aq) - e− ⇌ Ce3+(aq)
- (přibližně +1,44 V vs. ONA)
Vzhledem k velkému napětí článků je vodík (0 V vs. SHE) a kyslík (+1,23 V vs. SHE) se může teoreticky vyvinout jako vedlejší reakce během provozu na baterii (zejména při nabíjení).[11] Pozitivní elektrolyt je roztokem methansulfonát ceritý.
Historie a vývoj
Průtoková baterie s obsahem redoxu zinku a ceru byla poprvé navržena společností Clarke a spolupracovníky v roce 2004,[1][2] která byla základní technologií společnosti Plurion Inc. (UK). V roce 2008 utrpěla společnost Plurion Inc. krizi likvidity a v roce 2010 byla v likvidaci a společnost byla formálně rozpuštěna v roce 2012. Informace o experimentálních podmínkách a výkonu nabíjení popsané v raných patentech společnosti Plurion Inc. jsou však omezené. Od roku 2010 byly elektrochemické vlastnosti a charakterizace redoxní zinek-cérové redoxní baterie identifikovány výzkumnými pracovníky Southampton a Strathclyde Vysoké školy. V době cykly nabíjení / vybíjení při 50 mA cm−2, coulombická a napěťová účinnost redoxně-průtokové baterie s obsahem zinku a ceru byla údajně 92, respektive 68%.[12] V roce 2011 byl navržen membránový (nerozdělený) systém zinek-cer na bázi elektrolytu s nízkou koncentrací kyseliny s použitím stlačených kousků kladné elektrody z uhlíkové plsti. Uvádí se, že napětí výboje je přibližně 2,1 V a energetická účinnost je 75%. S takovou nedělenou konfigurací (jedno oddělení pro elektrolyt) bylo samovybíjení relativně nízké při nízkých koncentracích ceru a kyseliny.[13][14] Hlavní instalací zinek-cerium-redoxního průtokového akumulátoru bylo testovací zařízení> 2 kW v Glenrothes, Skotsko, instalováno společností Plurion Inc. Bylo zkoumáno použití směsných kyselých elektrolytů pro pozitivní poločlánek jako prostředek ke zvýšení kinetiky redoxní reakce ceru ve Státní klíčové laboratoři využití zdrojů vzácných zemin a na Jiangxi University of Science and Technology , Čína.[15][16] Platinové-iridiové povlaky ukázaly nejlepší výkon jako kladné elektrody pro baterii, přičemž jsou levnější než platinové elektrody.[17] Vybíjení systému bylo předběžně simulováno.[18] Výzkum směsných kyselin pokračuje a bylo prokázáno, že nízké koncentrace kyseliny chlorovodíkové mohou zlepšit elektrochemickou odezvu reakce ceru, zatímco přidání kyseliny dusičné mělo negativní výsledky.[19] Hierarchický porézní uhlík jako kladná elektroda přinesl lepší výkon než uhlíkový plsť při laboratorních experimentech.[20] Elektrodepozice zinku na záporné elektrodě byla studována pomocí Hullova článku.[21] Uhlíkový papír byl také studován jako alternativní materiál pro kladnou elektrodu.[22] Kompozity grafen-oxid-grafit ukázaly určité sliby jako lepší materiál katalytické elektrody pro reakci ceru v pozitivním elektrolytu.[23] Bylo navrženo podobné RFB s cerovým olovem.[24] Indium modifikované elektrody byly navrženy jako alternativa ke konvenčnímu grafitizovanému uhlíku jako záporné elektrody.[25] Systém Zn-Ce zavedl použití této kyseliny do jiných průtokových baterií jako lepší alternativu k kyselině sírové. Vztah mezi potenciálem buňky a hustotou proudu byl odhadnut pro průtokovou celu jednotky Zn-Ce.[26] To umožnilo racionalizovat příspěvek termodynamických, kinetických a ohmických složek napětí baterie a posoudit účinek zvětšení mezery mezi elektrodami.
Vývoj baterie Zn-Ce byl nedávno přezkoumán,[27] stejně jako elektrochemická technologie přeměny ceru pro průmyslové aplikace,[28] které zahrnují skladování energie, jadernou dekontaminaci, nepřímou organickou syntézu, ničení nebezpečných organických látek a čištění plynu.
Viz také
- Zásobárna energie
- Vyrovnávání zatížení
- Průtoková baterie
- Dobíjecí baterie
- Baterie (elektřina)
- Elektrochemický článek
- Seznam typů baterií
Reference
- ^ A b C R.L. Clarke, B.J. Dougherty, S. Harrison, P. J. Millington, S. Mohanta, USA 2004/0202925 A1, Cerium Batteries, (2004).
- ^ A b R.L. Clarke, B. J. Dougherty, S. Harrison, J. P. Millington, S. Mohanta, USA 2006/0063065 A1, Baterie s bifunkčním elektrolytem, (2005).
- ^ Leung, P.K .; Ponce de León, C .; Low, C.J.T .; Walsh, FC (2011). „Ce (III) / Ce (IV) v kyselině methansulfonové jako kladný poločlánek baterie s redoxním tokem“. Electrochimica Acta. 56 (5): 2145–2153. doi:10.1016 / j.electacta.2010.12.038.
- ^ A b Gernon, M. D .; Wu, M .; Buszta, T .; Janney, P. (1999). „Přínosy kyseliny methansulfonové pro životní prostředí: srovnávací vlastnosti a výhody“. Zelená chemie. 1 (3): 127–140. doi:10.1039 / a900157c.
- ^ Kreh, R.P .; Spotnitz, R.M .; Lundquist, J.T. (1989). "Zprostředkovaná elektrochemická syntéza aromatických aldehydů, ketonů a chinonů za použití cerického methansulfonátu". The Journal of Organic Chemistry. 54 (7): 1526–1531. doi:10.1021 / jo00268a010.
- ^ Nikiforidis, G .; Berlouis, L .; Hall, D .; Hodgson, D. (2012). „Hodnocení uhlíkových kompozitních materiálů pro zápornou elektrodu v redoxně-průtokové redoxní kyvetě“. Journal of Power Sources. 206: 497–503. doi:10.1016 / j.jpowsour.2011.01.036.
- ^ Nikiforidis, G .; Berlouis, L .; Hall, D .; Hodgson, D. (2013). „Studie různých uhlíkových kompozitních materiálů pro negativní poločlánkovou reakci hybridní redox průtokové cely se zinkem a cerem“. Electrochimica Acta. 113: 412–423. doi:10.1016 / j.electacta.2013.09.061.
- ^ Leung, P.K .; Ponce de León, C .; Low, C.T.J .; Walsh, FC (2011). „Depozice a rozpouštění zinku v kyselině methansulfonové na uhlíkovou kompozitní elektrodu jako reakce záporných elektrod v hybridní redoxní průtokové baterii“. Electrochimica Acta. 56 (18): 6536–6546. doi:10.1016 / j.electacta.2011.04.111.
- ^ Xie, Z .; Zhou, D .; Xiong, F .; Zhang, S .; Huang, K. (2011). „Cerium-zinková redoxní průtoková baterie: Pozitivní studie poločlánkového elektrolytu“. Journal of Rare Earths. 29 (6): 567–573. doi:10.1016 / S1002-0721 (10) 60499-1.
- ^ Nikiforidis, G .; Berlouis, L .; Hall, D .; Hodgson, D. (2014). „Cykly nabíjení / vybíjení na elektrodách založených na Pt a Pt-Ir pro kladnou stranu hybridního redox průtokového akumulátoru Zinc-Cerium“. Electrochimica Acta. 125: 176–182. doi:10.1016 / j.electacta.2014.01.075.
- ^ Nikiforidis, G .; Berlouis, L .; Hall, D .; Hodgson, D. (2013). "Dopad složení elektrolytu na výkonnost zincecerium redoxního bateriového systému". Journal of Power Sources. 243: 691–698. doi:10.1016 / j.jpowsour.2013.06.045.
- ^ Leung, P.K .; Ponce de León, C .; Low, C.T.J .; Shah, A.A .; Walsh, FC (2011). "Charakterizace zinko-cerové průtokové baterie". Journal of Power Sources. 196 (11): 5174–5185. doi:10.1016 / j.jpowsour.2011.01.095.
- ^ Leung, P.K .; Ponce-de-Leon, C .; Walsh, FC (2011). "Nerozdělený zinek-cerový redoxní průtokový akumulátor pracující při pokojové teplotě (295 K)". Elektrochemická komunikace. 13 (8): 770–773. doi:10.1016 / j.elecom.2011.04.011.
- ^ Leung, P.K .; Ponce de León, C .; Walsh, FC (2012). "Vliv provozních parametrů na výkon nerozděleného zink-cerového průtokového akumulátoru". Electrochimica Acta. 80: 7–14. doi:10.1016 / j.electacta.2012.06.074.
- ^ Xie, Z .; Xiong, F .; Zhou, D. (2011). "Studie redoxního páru Ce3 + / Ce4 + ve směsných kyselých médiích (CH3SO3H a H2SO4) pro použití redox flow baterie". Energie a paliva. 25 (5): 2399–2404. doi:10.1021 / ef200354b.
- ^ Xie, Z .; Liu, Q .; Chang, Z .; Zhang, X. (2013). „Vývoj a výzvy poločlánku ceru v redox průtokové baterii zinku a ceru pro skladování energie“. Electrochimica Acta. 90: 695–704. doi:10.1016 / j.electacta.2012.12.066.
- ^ Nikiforidis, G .; Berlouis, L .; Hall, D .; Hodgson, D. (2014). „Elektrochemická studie na straně kladných elektrod hybridní redox průtokové baterie zinku a ceru“. Electrochimica Acta. 115: 621–629. doi:10.1016 / j.electacta.2013.09.081.
- ^ Halls, J. E.; Hawthornthwaite, A .; Hepworth, R.J .; Roberts, NA; Wright, K.J .; Zhou, Y .; Haswell, S.J .; Haywood, S.K .; Kelly, S.M .; Lawrence, N.S .; Wadhawan, J.D. (2013). „Posílení inteligentní sítě: mohou být redoxní baterie přizpůsobeny systémům obnovitelné energie pro skladování energie?“ (PDF). Energetika a věda o životním prostředí. 6 (3): 1026. doi:10,1039 / c3ee23708g. hdl:10536 / DRO / DU: 30063527.
- ^ Nikiforidis, G .; Daoud, W.A. (2014). „Vliv smíšeného kyselého média na pozitivní stránku hybridní redoxní průtokově redoxní baterie“. Electrochimica Acta. 141: 255–262. doi:10.1016 / j.electacta.2014.06.142.
- ^ Xie, Z .; Yang, B .; Cai, D .; Yang, L. (2014). „Hierarchický porézní uhlík směrem k účinné katodě v pokročilé redoxně-průtokově redoxní baterii s průtokem“. Journal of Rare Earths. 32 (10): 973–978. doi:10.1016 / S1002-0721 (14) 60171-X.
- ^ Nikiforidis, G .; Cartwright, R .; Hodgson, D .; Hall, D .; Berlouis, L. (2014). „Faktory ovlivňující výkon redox průtokové baterie Zn-Ce“ (PDF). Electrochimica Acta. 140: 139–144. doi:10.1016 / j.electacta.2014.04.150.
- ^ Nikiforidis, G .; Xiang, Y .; Daoud, W.A. (2015). „Elektrochemické chování uhlíkového papíru na elektrolytech cermethansulfonátu pro průtokovou baterii zinek-cer“. Electrochimica Acta. 157: 274–281. doi:10.1016 / j.electacta.2014.11.134.
- ^ Xie, Z .; Yang, B .; Yang, L .; Xu, X .; Cai, D .; Chen, J .; Chen, Y .; Ahoj.; Li, Y .; Zhou, X. (2015). "Přidání oxidu grafenu do grafitu směrem k efektivní kladné elektrodě pro pokročilý zinek-cerový redox průtokový akumulátor". Journal of Solid State Electrochemistry. 19 (11): 3339–3345. doi:10.1007 / s10008-015-2958-9. S2CID 93129998.
- ^ Na, Z .; Xu, S .; Yin, D .; Wang, L (2015). „Cereo-olověný redoxní bateriový systém využívající podpůrný elektrolyt kyseliny methansulfonové“. Journal of Power Sources. 295: 28–32. doi:10.1016 / j.jpowsour.2015.06.115.
- ^ Nikiforidis, G .; Daoud, W.A. (2015). "Indium modifikované grafitové elektrody na vysoce zinkovém methansulfonátovém elektrolytu pro zinko-cero-redoxní průtokovou baterii". Electrochimica Acta. 168: 394–402. doi:10.1016 / j.electacta.2015.03.118.
- ^ Arenas, L.F .; Walsh, F.C .; de Leon, C. (2015). „Důležitost geometrie článků a vlastností elektrolytu pro potenciál článků hybridních průtokových baterií Zn-Ce“. Journal of the Electrochemical Society. 163 (1): A5170 – A5179. doi:10.1149 / 2.0261601jes.
- ^ Walsh, Frank C .; Ponce de Léon, Carlos; Berlouis, Len; Nikiforidis, George; Arenas-Martínez, Luis F .; Hodgson, David; Hall, David (2015). „Vývoj hybridních redoxních baterií Zn-Ce pro skladování energie a jejich pokračující výzvy“ (PDF). ChemPlusChem. 80 (2): 288–311. doi:10.1002 / cplu.201402103.
- ^ Arenas, L.F .; Ponce de León, C .; Walsh, FC (2016). „Elektrochemické redoxní procesy zahrnující rozpustné druhy ceru“ (PDF). Electrochimica Acta. 205: 226–247. doi:10.1016 / j.electacta.2016.04.062.

