Krotamin - Crotamine
| Krotamin | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
| Identifikátory | |||||||
| Organismus | ? | ||||||
| Symbol | CRO2 | ||||||
| UniProt | Q9PWF3 | ||||||
| |||||||
Krotamin je toxin přítomný v jed z jihoamerický chřestýš (Crotalus durissus terrificus ). Je to 42 zbytků dlouhý protein obsahující 11 bazických zbytků (9 lysiny, 2 argininy ) a 6 cysteiny. Rovněž byl izolován od jedu severoamerického prérijního chřestýša, Crotalus viridis viridis. Poprvé byl izolován a čištěn brazilským vědcem José Moura Gonçalves, a později intenzivně studoval jeho skupina spolupracovníků na Lékařská fakulta Ribeirão Preto z University of Sao Paulo.
Biologická funkce
Crotamin má řadu biologických účinků: působí na buněčnou membránu sodíkové kanály, je mírně analgetikum a je myotoxický, tj. proniká do buněk svaly a propaguje nekróza. Crotamin je homologní s jiným jedem myotoxiny a je podobný α-, β-defensiny.
Biochemie a mechanismus
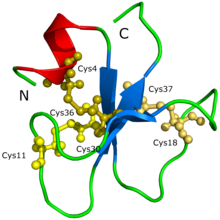
The aminokyselina sekvence, YKQCHKKGGHCFPKEKICLPPSSDFGKMDCRWRWKCCKKGS — 0a 3D molekulární struktura krotaminu již byly stanoveny.
The protein struktura krotaminu nemohla být zpočátku stanovena prostřednictvím krystalizace bílkovin ani Rentgenová difrakce.[1] Spekulovalo se, že problém spočíval v tom, že krotamin má tolik izoforem, což vede k tvorbě agregátů a různým možným konformacím proteinu. Struktura a tvar proteinu byly navrženy prostřednictvím 3D modelu generovaného Siqueirou a kol. (2002) založené na výpočtových výpočtech, které byly podpořeny intenzivními simulacemi molekulární dynamiky a postupy modelování homologie. Poté Nicastro a kol. (2003) objevili strukturu krotaminu spektroskopie nukleární magnetické rezonance. Crotamin má topologii, kterou nikdy předtím neviděli u aktivních toxinů zaměřených na iontové kanály; protein je složen z krátkého N-konce alfa šroubovice, typ tvorby proteinu a malý antiparalelní trojvláknový beta-list, další typ tvorby proteinu, uspořádaný v topologii ab1b2b3. Crotamin má podobné strukturní skládací konformace jako člověk b-defensin rodinné i identické disulfidové můstky dohoda.[1]
[Obrázek je nutný]
The gen a chromozóm místo odpovědné za jeho syntézu určila skupina vedená Gandhi Rádis-Baptista, pracující v Instituto Butantan v São Paulu v Brazílii. The mRNA má asi 340 nukleotidy a kodifikuje předkrotamin, včetně signální peptid, zralý krotamin a konečný lysin.
Gen krotaminu byl prvním genem, který byl mapován na hadím chromozomu.[1]Gen odpovědný za kódování proteinu krotaminu je označen jako Crt-p1 a jeho délka sekvence párů bází je asi 1,1 kb / s nebo 1100 bp. Bylo hlášeno, že gen krotaminu byl izolován dvakrát ze dvou různých vzorků, jeden způsobem, který velikost genu 1,8 kbp a u druhého vzorku velikost genu 1,1 kbp.[2] Gen byl dříve izolován v C. durissus terrificus genom a samotný protein patří do skupiny malých bazických polypeptid myotoxiny (SBPM). Obsah jedů Crotalus se může lišit podle poddruhu a zeměpisného umístění.[3] Gen Crt-p1, jak jej popsali Radis-Bastista et al. 2003, se skládá z přibližně tří exonů oddělených jedním krátkým intronem fáze 2 (140 bp) a jedním dlouhým intronem fáze 1 (900 bp). Exon 1 kóduje prvních 19 aminokyselin signálního peptidu a zahrnuje 5'-nepřekládanou oblast. Exon 2 kóduje 39 aminokyselin na zralý krotamin a tři signální peptidové aminokyseliny. Exon 3 kóduje terminální lysin a poslední tři aminokyseliny zralého toxinu. Výzkum sekvencí aminokyselin SBPM mezi různými druhy Crotalus odhalil vysoký stupeň podobnosti v rozmezí od 83% do 98%.[2]
Aminokyselinový kód proteinů v rodině malých bazických polypeptidových myotoxinů, který zahrnuje krotamin, byl sekvenován. Bylo zjištěno, že jsou si podobné s průměrnou odchylkou 83%. Sekvence aminokyselin krotaminu byla porovnána s aminokyselinovou sekvencí krotaminu klonovaná DNA myotoxinu a (myotoxin použitý k modelování fungování SBPM). Ve srovnání byly oblasti kódující exon včetně zralého myotoxinu a signálního peptidu podobné 98% a 100%. Nepřekládané oblasti pro 5 'a 3' mezi vzorkem a myotoxinem a cDNA byly 60%, respektive 80%. Při srovnání aminokyselinových sekvencí jiných proteinů, které nejsou v rodině SBPM nalezených v hadích jedech, obvykle dochází k velké divergenci. Při pohledu na proteiny SBPM mají vysokou podobnost mezi různými poddruhy rodu Crotalus a mezi různými jedinci stejného poddruhu. To podle Radis-Batisty et al. Studie z roku 2003, podle níž se gen krotaminu a další geny SBPM nedávno vyvinuly.
Reference
- ^ A b C Oguiura N, Boni-Mitake M, Rádis-Baptista G (září 2005). „Nový pohled na krotamin, malý základní polypeptidový myotoxin z jihoamerického jedu chřestýše“. Toxicon. 46 (4): 363–70. doi:10.1016 / j.toxicon.2005.06.009. PMID 16115660.
- ^ A b Samejima Y, Aoki Y, Mebs D (1991). "Aminokyselinová sekvence myotoxinu z jedu chřestýše východní (Crotalus adamanteus)". Toxicon. 29 (4–5): 461–8. doi:10.1016 / 0041-0101 (91) 90020-r. PMID 1862521.
- ^ Schenberg S (květen 1959). "Geografický vzorec distribuce krotaminu ve stejném poddruhu chřestýša". Věda. 129 (3359): 1361–3. doi:10.1126 / science.129.3359.1361. PMID 13658964.
Další čtení
- Goncalves JM, Deutsch HF (únor 1956). „Ultracentrifugální a zónová elektroforéza některých jedů Crotalidae“. Archivy biochemie a biofyziky. 60 (2): 402–11. doi:10.1016/0003-9861(56)90444-1. PMID 13292919.
- Giglio JR (listopad 1975). "Analytické studie na hydrochloridu krotaminu". Analytická biochemie. 69 (1): 207–21. doi:10.1016/0003-2697(75)90581-3. PMID 2030.
- Laure CJ (únor 1975). "[Primární struktura krotaminu (překlad autora)]" ". Hoppe-Seyler's Zeitschrift für Physiologische Chemie (v němčině). 356 (2): 213–5. PMID 1176086.
- De Lucca FL, Imaizumi MT, Haddad A (duben 1974). "Charakterizace ribonukleových kyselin z jedových žláz Crotalus durissus terrifucus (Ophidia, Reptilia) po manuální extrakci jedu. Studie aktivity templátu a složení báze". The Biochemical Journal. 139 (1): 151–6. doi:10.1042 / bj1390151. PMC 1166261. PMID 4463939.
- Ownby CL, Cameron D, Tu AT (říjen 1976). "Izolace myotoxické složky z jedu chřestýše (Crotalus viridis viridis). Elektronová mikroskopická analýza poškození svalů". American Journal of Pathology. 85 (1): 149–66. PMC 2032543. PMID 970437.
- Rádis-Baptista G, Oguiura N, Hayashi MA, Camargo ME, Grego KF, Oliveira EB, Yamane T (červenec 1999). "Nukleotidová sekvence prekurzorů izoformy krotaminu od jediného chřestýša jihoamerického (Crotalus durissus terrificus)". Toxicon. 37 (7): 973–84. doi:10.1016 / s0041-0101 (98) 00226-8. PMID 10484745.
- Kerkis A, Kerkis I, Rádis-Baptista G, Oliveira EB, Vianna-Morgante AM, Pereira LV, Yamane T (září 2004). „Crotamin je nový protein pronikající buňkami z jedu chřestýše Crotalus durissus terrificus.“ FASEB Journal. 18 (12): 1407–9. doi:10.1096 / fj.03-1459fje. PMID 15231729. S2CID 20510076.
- Rádis-Baptista G, Kubo T, Oguiura N, Prieto da Silva AR, Hayashi MA, Oliveira EB, Yamane T (červen 2004). „Identifikace krotasinu, genu Crotalus durissus terrificus souvisejícího s krotaminem“. Toxicon. 43 (7): 751–9. doi:10.1016 / j.toxicon.2004.02.023. PMID 15284009.
- Rádis-Baptista G, Kubo T, Oguiura N, Svartman M, Almeida TM, Batistic RF a kol. (Prosinec 2003). "Struktura a chromozomální lokalizace genu pro krotamin, toxin z jihoamerického chřestýša, Crotalus durissus terrificus". Toxicon. 42 (7): 747–52. doi:10.1016 / j.toxicon.2003.10.019. PMID 14757205.
- Nicastro G, Franzoni L, de Chiara C, Mancin AC, Giglio JR, Spišská A (květen 2003). "Struktura řešení krotaminu, kanálu Na + ovlivňujícího toxin z jedu Crotalus durissus terrificus". European Journal of Biochemistry. 270 (9): 1969–79. doi:10.1046 / j.1432-1033.2003.03563.x. PMID 12709056. S2CID 20601072.
- Mouhat S, Jouirou B, Mosbah A, De Waard M, Sabatier JM (březen 2004). „Rozmanitost záhybů zvířecích toxinů působících na iontové kanály“. The Biochemical Journal. 378 (Pt 3): 717–26. doi:10.1042 / BJ20031860. PMC 1224033. PMID 14674883.
externí odkazy
- Sekvence nukleotidů a translace pro krotasin. Entrez databáze. Národní centrum pro biotechnologické informace.
