Migrace buněk - Cell migration - Wikipedia
Migrace buněk je ústředním procesem při vývoji a údržbě mnohobuněčné organismy. Tvorba tkání během embryonální vývoj, hojení ran a imunitní odpovědi všechny vyžadují řízený pohyb buněk v konkrétních směrech do konkrétních umístění. Buňky často migrují v reakci na konkrétní externí signály, včetně chemické signály a mechanické signály.[1] Chyby během tohoto procesu mají vážné důsledky, včetně mentální postižení, cévní onemocnění, tvorba nádoru a metastáza. Pochopení mechanismu, kterým buňky migrují, může vést k vývoji nových terapeutických strategií pro kontrolu, například invazivních nádorových buněk.
Vzhledem k vysoce viskóznímu prostředí (nízké Reynoldsovo číslo ), buňky musí nepřetržitě vytvářet síly, aby se mohly pohybovat. Buňky dosahují aktivního pohybu velmi odlišnými mechanismy. Mnoho méně složitých prokaryotických organismů (a spermií) používá bičíky nebo řasy pohánět se. Eukaryotický buněčná migrace je obvykle mnohem složitější a může se skládat z kombinací různých mechanismů migrace. Obvykle zahrnuje drastické změny ve tvaru buňky, které jsou způsobeny cytoskelet. Dva velmi odlišné scénáře migrace jsou procházení pohybem (nejčastěji studované) a pohyblivost bublin.[2][3] Paradigmatickým příkladem plazivého pohybu je případ rybích epidermálních keratocytů, které byly široce používány ve výzkumu a výuce.[4]
Studie buněčné migrace
Migrace kultivované buňky připojené k povrchu nebo ve 3D se běžně studuje pomocí mikroskopie.[5][6][3]Protože pohyb buněk je velmi pomalý, několik µm / minutu, časosběrná mikroskopie jsou zaznamenávána videa migrujících buněk pro zrychlení pohybu. Tato videa (obrázek 1) ukazují, že přední část přední buňky je velmi aktivní s charakteristickým chováním postupných kontrakcí a expanzí. Obecně se uznává, že přední přední strana je hlavní motor, který táhne buňku vpřed.
Společné rysy
Předpokládá se, že procesy, které jsou základem migrace savčích buněk, jsou v souladu s procesy (spermatozooikum ) pohyb.[7] Společná pozorování zahrnují:
- cytoplazmatický posun na náběžné hraně (přední)
- laminární odstranění dorzálně nahromaděných nečistot směrem k zadní hraně (vzadu)
Druhá vlastnost je nejsnáze pozorovatelná, když jsou agregáty povrchové molekuly zesítěny fluorescencí protilátka nebo když se malé kuličky uměle navážou na přední část buňky.[8]
Podobně migrují i další eukaryotické buňky. Améba Dictyostelium discoideum je užitečný pro vědce, protože důsledně vykazují chemotaxi v reakci na cyklický AMP; pohybují se rychleji než kultivované savčí buňky; a mají haploidní genom, který zjednodušuje proces spojování konkrétního genového produktu s jeho účinkem na buněčné chování.[9]


Molekulární procesy migrace
Existují dvě hlavní teorie o tom, jak buňka posouvá svůj přední okraj: cytoskeletální model a model proudění membrány. Je možné, že oba základní procesy přispívají k prodloužení buněk.
Cytoskeletální model (A)
Náběžná hrana
Experimenty ukázaly, že je rychlý aktin polymerace na přední hraně buňky.[10] Toto pozorování vedlo k hypotéze, že tvorba aktinových vláken „tlačí“ přední hranu dopředu a je hlavní hybnou silou pro postup přední hrany buňky.[11][12] Cytoskeletální prvky jsou navíc schopné intenzivně a důvěrně interagovat s plazmatickou membránou buňky.[13]
Odtoková hrana
Další cytoskeletální složky (jako mikrotubuly) mají důležitou funkci při migraci buněk. Bylo zjištěno, že mikrotubuly působí jako „vzpěry“, které působí proti kontraktilním silám, které jsou potřebné pro odtažení zadní hrany během pohybu buňky. Když jsou mikrotubuly v odtokové hraně buňky dynamické, jsou schopny remodelovat, aby umožnily zatažení. Když je dynamika potlačena, mikrotubuly se nemohou přetvořit, a proto se postavit proti kontraktilním silám.[14] Morfologie buněk s potlačenou dynamikou mikrotubulů naznačuje, že buňky mohou prodloužit přední okraj (polarizovaný ve směru pohybu), ale mají potíže se zasunutím své zadní hrany.[15] Na druhou stranu vysoké koncentrace léčiva nebo mutace mikrotubulů, které depolymerují mikrotubuly, mohou obnovit migraci buněk, ale dochází ke ztrátě směrovosti. Lze dojít k závěru, že mikrotubuly působí jak k omezení pohybu buněk, tak k zajištění směrovosti.
Membránový průtokový model (B)
Studie také ukázaly, že přední část migrace je místo, kde se membrána vrací na povrch buněk z vnitřních membránových bazénů na konci endocytový cyklus.[16] To vedlo k hypotéze, že k prodloužení náběžné hrany dochází primárně přidáním membrány v přední části buňky. Pokud ano, aktinová vlákna, která se tvoří na přední straně, mohou stabilizovat přidanou membránu tak, že se vytvoří strukturovaný nástavec nebo lamela, spíše než bublinová struktura (nebo výhonek) na její přední straně.[17] Aby se buňka mohla pohybovat, je nutné si přinést novou zásobu „nohou“ (tzv. Bílkovin integriny, které připevňují buňku k povrchu, po kterém se plazí) zepředu. Je pravděpodobné, že tyto nohy jsou endocytovány směrem k zadní části buňky a přivedeny na přední stranu buňky exocytózou, aby byly znovu použity k vytvoření nových vazeb k substrátu.

Mechanické základy migrace améboidů
Procházení lepidlem není jediným režimem migrace, který vykazují eukaryotické buňky. Důležité je, že metastatické rakovinné buňky a imunitní buňky mají rádi makrofágy a neutrofily bylo zjištěno, že jsou schopné migrace nezávislé na adhezi. Mechanický základ tohoto migračního režimu je méně pochopitelný než plazení mikroorganizmy na základě eukaryotických buněk nebo plavání na bázi bičíků. Fyzik E. M. Purcell domníval se, že za podmínek nízké Reynoldsovo číslo dynamika tekutin, která platí v buněčném měřítku, by mohl povrchový tok dozadu poskytnout mechanismus pro plavení mikroskopických předmětů dopředu.[19] Po několika desetiletích byla experimentální podpora tohoto modelu poskytována pomocí optogenetika. Ukázalo se, že buňky migrující améboidním způsobem bez adhezí vykazují tok plazmatické membrány směrem k zadní části buňky, který může pohánět buňky vyvíjením tangenciálních sil na okolní tekutinu.[18][20] Polarizovaný přenos membrán obsahujících vezikulů zezadu do přední části buňky pomáhá udržovat velikost buňky.[18] Průtok membránou dozadu byl také pozorován u Dictyostelium discoideum buňky.[21] Je zajímavé, že bylo také zjištěno, že migrace supracelulárních shluků je podporována podobným mechanismem toku dozadu.[22]
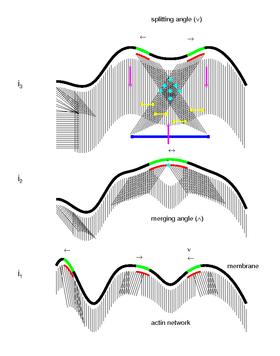
Kolektivní biomechanický a molekulární mechanismus pohybu buněk
Na základě některých matematických modelů předpokládají nedávné studie nový biologický model pro kolektivní biomechanický a molekulární mechanismus pohybu buněk.[23] Navrhuje se, aby mikrodomény tkaly strukturu cytoskeletu a jejich interakce označovaly místo pro vznik nových adhezních míst. Podle tohoto modelu dynamika signalizace mikrodomény organizuje cytoskelet a jeho interakci se substrátem. Jak mikrodomény spouští a udržují aktivní polymeraci aktinových vláken, jejich šíření a klikatý pohyb na membráně generují vysoce propojenou síť zakřivených nebo lineárních vláken orientovaných v širokém spektru úhlů k hranici buňky. Rovněž se navrhuje, aby interakce mikrodomény značila tvorbu nových fokálních adhezních míst na periferii buněk. Interakce myosinu se sítí aktinů poté generuje membránovou retrakci / ruffling, retrográdní tok a kontraktilní síly pro dopředný pohyb. A konečně, kontinuální aplikace stresu na stará místa ohniskové adheze může vést k aktivaci kalpainu vyvolané vápníkem a následně k oddělení ohniskových adhezí, které dokončí cyklus.
Polarita při migraci buněk
Migrující buňky mají a polarita —Předu a vzadu. Bez ní by se pohybovali všemi směry najednou, tj. Šířili se. Jak je tato polarita formulována na molekulární úrovni uvnitř buňky, není známo. V buňce, která se meandruje náhodným způsobem, může přední strana snadno ustoupit, aby se stala pasivní, protože některá další oblast nebo oblasti buňky tvoří novou frontu. V buňkách chemotaxe se stabilita přední strany jeví posílená, jak buňka postupuje směrem k vyšší koncentraci stimulující chemické látky. Tato polarita se odráží na molekulární úrovni omezením určitých molekul na konkrétní oblasti vnitřní povrch buňky. Tedy fosfolipid PIP3 a aktivoval Rac a CDC42 se nacházejí v přední části buňky, zatímco Rho GTPáza a PTEN se nacházejí směrem dozadu.[24][25]
Předpokládá se, že vláknité aktiny a mikrotubuly jsou důležité pro stanovení a udržení polarity buňky.[Citace je zapotřebí ] Léky, které ničí aktinová vlákna, mají více a složitější účinky, což odráží širokou roli, kterou tato vlákna hrají v mnoha buněčných procesech. Může se stát, že v rámci pohybového procesu bude membrána vezikuly jsou transportována podél těchto vláken na přední stranu buňky. V buňkách chemotaxingu může zvýšená perzistence migrace směrem k cíli vyplývat ze zvýšené stability uspořádání vláknitých struktur uvnitř buňky a určovat její polaritu. Tyto vláknité struktury mohou být zase uspořádány uvnitř buňky podle toho, jak jsou molekuly jako PIP3 a PTEN uspořádány na vnitřní buněčné membráně. A kde se nacházejí, se zase jeví být určeno chemoatraktivním signálem, protože tyto narážejí na konkrétní receptory na vnějším povrchu buňky.
Ačkoli je známo, že mikrotubuly ovlivňují migraci buněk po mnoho let, mechanismus, kterým to dělají, zůstal kontroverzní. Na rovinném povrchu nejsou pro pohyb potřebné mikrotubuly, ale jsou nutné k zajištění směrovosti pohybu buněk a účinného výčnělku náběžné hrany.[15][26] Pokud jsou přítomny, mikrotubuly zpomalují pohyb buněk, když je jejich dynamika potlačena léčbou léky nebo mutacemi tubulinu.[15]
Inverzní problémy v kontextu buněčné motility
Oblast výzkumu zvaná inverzní problémy byla stanovena buněčná motilita. [27][28][23]Tento přístup je založen na myšlence, že změny chování nebo tvaru buňky nesou informace o základních mechanismech, které tyto změny generují. Čtení pohybu buněk, jmenovitě porozumění základním biofyzikálním a mechanochemickým procesům, má zásadní význam.[29][30]Matematické modely vyvinuté v těchto pracích určují některé fyzikální vlastnosti a materiálové vlastnosti buněk lokálně analýzou sekvencí živých buněčných obrazů a používají tyto informace k dalším závěrům o molekulárních strukturách, dynamice a procesech v buňkách, jako je aktin síť, mikrodomény, chemotaxe, adheze a retrográdní tok.
Viz také
- Tvorba čepice
- Chemotaxe
- Kolektivní migrace buněk
- Durotaxis
- Endocytický cyklus
- Myší modely metastáz rakoviny prsu
- Neurofilní
- Dynamika proteinů
Reference
- ^ Mak, M .; Spill, F .; Roger, K .; Zaman, M. (2016). „Migrace jedné buňky ve složitých mikroprostředí: mechanika a dynamika signalizace“. Journal of Biomechanical Engineering. 138 (2): 021004. doi:10.1115/1.4032188. PMC 4844084. PMID 26639083.
- ^ Huber, F; Schnauss, J; Roenicke, S; Rauch, P; Mueller, K; Fuetterer, C; Kaes, J (2013). „Naléhavá složitost cytoskeletu: od jednotlivých vláken k tkáni“. Pokroky ve fyzice. 62 (1): 1–112. Bibcode:2013AdPhy..62 .... 1H. doi:10.1080/00018732.2013.771509. PMC 3985726. PMID 24748680. online
- ^ A b Pebworth, Mark-Phillip; Cismas, Sabrina A .; Asuri, Prashanth (2014). „Nová platforma pro 2.5D kultivaci pro zkoumání role gradientů tuhosti na migraci buněk nezávislou na adhezi“. PLOS ONE. 9 (10): e110453. Bibcode:2014PLoSO ... 9k0453P. doi:10.1371 / journal.pone.0110453. ISSN 1932-6203. PMC 4195729. PMID 25310593.
- ^ Prieto, Daniel; Aparicio, Gonzalo; Sotelo-Silveira, Jose R. (19. června 2017). „Analýza migrace buněk: nízkonákladový laboratorní experiment pro kurzy buněčné a vývojové biologie s použitím keratocytů z rybích šupin“. Výuka biochemie a molekulární biologie. 45 (6): 475–482. doi:10,1002 / bmb.21071. PMID 28627731.
- ^ Dormann, Dirk; Weijer, Cornelis J. (08.08.2006). „Zobrazování migrace buněk“. Časopis EMBO. 25 (15): 3480–3493. doi:10.1038 / sj.emboj.7601227. ISSN 0261-4189. PMC 1538568. PMID 16900100.
- ^ Shih, Wenting; Yamada, Soichiro (2011-12-22). „Zobrazení živých buněk migrujících buněk exprimujících fluorescenčně značené proteiny v trojrozměrné matici“. Žurnál vizualizovaných experimentů (58). doi:10.3791/3589. ISSN 1940-087X. PMC 3369670. PMID 22215133.
- ^ „Co je migrace buněk?“. Brána pro migraci buněk. Konsorcium pro buněčnou migraci. Archivovány od originál dne 22. října 2014. Citováno 24. března 2013.
- ^ Abercrombie, M; Heaysman, JE; Pegrum, SM (1970). „Pohyb fibroblastů v kultuře III. Pohyby částic na hřbetním povrchu přední lamely“. Experimentální výzkum buněk. 62 (2): 389–98. doi:10.1016/0014-4827(70)90570-7. PMID 5531377.
- ^ Willard, Stacey S; Devreotes, Peter N (2006-09-27). „Signální dráhy zprostředkující chemotaxi v sociální amébě, Dictyostelium discoideum“. European Journal of Cell Biology. 85 (9–10): 897–904. doi:10.1016 / j.ejcb.2006.06.003. ISSN 0171-9335. PMID 16962888.
- ^ Wang, Y. L. (1985). „Výměna aktinových podjednotek na špici živých fibroblastů: možná role běžícího pásu“. The Journal of Cell Biology. 101 (2): 597–602. doi:10.1083 / jcb.101.2.597. PMC 2113673. PMID 4040521.
- ^ Mitchison, T; Cramer, LP (1996). "Actin-Based Cell Motility and Cell Locomotion". Buňka. 84 (3): 371–9. doi:10.1016 / S0092-8674 (00) 81281-7. PMID 8608590. S2CID 982415.
- ^ Pollard, Thomas D; Borisy, Gary G (2003). "Buněčná pohyblivost řízená montáží a demontáží aktinových vláken". Buňka. 112 (4): 453–65. doi:10.1016 / S0092-8674 (03) 00120-X. PMID 12600310. S2CID 6887118.
- ^ Doherty, Gary J .; McMahon, Harvey T. (2008). „Zprostředkování, modulace a důsledky interakcí membrána-cytoskelet“. Roční přehled biofyziky. 37: 65–95. doi:10.1146 / annurev.biophys.37.032807.125912. PMID 18573073.
- ^ Yang, Hailing; Ganguly, Anutosh; Cabral, Fernando (2010). „Inhibice buněčné migrace a dělení buněk koreluje s výraznými účinky léků inhibujících mikrotubuly“. The Journal of Biological Chemistry. 285 (42): 32242–50. doi:10.1074 / jbc.M110.160820. PMC 2952225. PMID 20696757.
- ^ A b C Ganguly, A; Yang, H; Sharma, R; Patel, K; Cabral, F (2012). „Role mikrotubulů a jejich dynamika při migraci buněk“. J Biol Chem. 287 (52): 43359–69. doi:10,1074 / jbc.M112.423905. PMC 3527923. PMID 23135278.
- ^ Bretscher, M. S. (1983). „Distribuce receptorů pro transferin a lipoproteiny s nízkou hustotou na povrchu obrovských buněk HeLa“. Sborník Národní akademie věd. 80 (2): 454–8. Bibcode:1983PNAS ... 80..454B. doi:10.1073 / pnas.80.2.454. PMC 393396. PMID 6300844.
- ^ Bretscher, M (1996). "Přimět membránový tok a cytoskelet k spolupráci při pohybu buněk". Buňka. 87 (4): 601–6. doi:10.1016 / S0092-8674 (00) 81380-X. PMID 8929529. S2CID 14776455.
- ^ A b C O'Neill, Patrick; Castillo-Badillo, Jean; Meshik, Xenia; Kalyanaraman, Vani; Melgarejo, Krystal; Gautam, N (2018). „Membránový tok řídí režim migrace améboidních buněk nezávislý na adhezi“. Vývojová buňka. 46 (1): 9–22. doi:10.1016 / j.devcel.2018.05.029. PMC 6048972. PMID 29937389.
- ^ Purcell, E. M. (1977). „Life at Low Reynolds Number“. American Journal of Physics. 45 (3): 3–11. Bibcode:1977AmJPh..45 .... 3P. doi:10.1119/1.10903. hdl:2433/226838.
- ^ Bell, George R. R .; Collins, Sean R. (2018). ""Rho "ing celulární člun se zpětným prouděním membrány". Vývojová buňka. 46 (1): 1–3. doi:10.1016 / j.devcel.2018.06.008. PMID 29974859.
- ^ Tanaka, Masahito; Kikuchi, Takeomi; Uno, Hiroyuki; Okita, Keisuke; Kitanishi-Yumura, Toshiko; Yumura, Shigehiko (2017). "Obrat a tok buněčné membrány pro migraci buněk". Vědecké zprávy. 7 (1): 12970. Bibcode:2017NatSR ... 712970T. doi:10.1038 / s41598-017-13438-5. PMC 5636814. PMID 29021607.
- ^ Shellard, Adam; Szabo, Andras; Trepat, Xavier; Mayor, Roberto (2018). „Supracelulární kontrakce v zadní části buněčných skupin neurální lišty řídí kolektivní chemotaxi“. Věda. 362 (6412): 339–343. Bibcode:2018Sci ... 362..339S. doi:10.1126 / science.aau3301. PMC 6218007. PMID 30337409.
- ^ A b C Coskun, Hasan; Coskun, Huseyin. (Březen 2011). "Buněčný lékař: čtení pohybu buňky. Matematická diagnostická technika prostřednictvím analýzy pohybu jedné buňky". Bull Math Biol. 73 (3): 658–82. doi:10.1007 / s11538-010-9580-x. PMID 20878250. S2CID 37036941.
- ^ Parent, C. A .; Devreotes, PN (1999). „Smysl celé buňky“. Věda. 284 (5415): 765–70. Bibcode:1999Sci ... 284..765P. doi:10.1126 / science.284.5415.765. PMID 10221901.
- ^ Ridley, A. J .; Schwartz, MA; Burridge, K; Firtel, RA; Ginsberg, MH; Borisy, G; Parsons, JT; Horwitz, AR (2003). „Migrace buněk: integrace signálů zepředu dozadu“. Věda. 302 (5651): 1704–9. Bibcode:2003Sci ... 302.1704R. doi:10.1126 / science.1092053. PMID 14657486. S2CID 16029926.
- ^ Meyer, A.S .; Hughes-Alford, S.K .; Kay, J. E.; Castillo, A .; Wells, A .; Gertler, F.B .; Lauffenburger, D.A. (2012). „2D výčnělek, ale ne motilita předpovídá migraci rakovinných buněk vyvolanou růstovým faktorem ve 3D kolagenu“. J. Cell Biol. 197 (6): 721–729. doi:10.1083 / jcb.201201003. PMC 3373410. PMID 22665521.
- ^ Coskun, Huseyin. (2006). Matematické modely pro pohyblivost ameboidních buněk a modelové inverzní problémy - přes ProQuest.
- ^ Coskun, Huseyin; Li, Yi; Mackey, Mackey A. (leden 2007). "Ameboidní buněčná motilita: problém modelu a inverze s aplikací na zobrazovací data živých buněk". J Theor Biol. 244 (2): 169–79. doi:10.1016 / j.jtbi.2006.07.025. PMID 16997326.
- ^ "Profilování buněk pomocí matematiky". Mathematical Association of America.
- ^ „Matematici používají k detekci abnormalit - včetně rakoviny -„ profilování “buněk. ScienceDaily.
externí odkazy
- Brána pro migraci buněk Brána pro migraci buněk je komplexní a pravidelně aktualizovaný zdroj o migraci buněk
- Cytoskelet a buněčná migrace Prohlídka obrázků a videí v malé laboratoři J. V. v Salcburku a ve Vídni

