Benzylidenaceton - Benzylideneacetone
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC (E) -4-fenylbut-3-en-2-on | |
| Ostatní jména Benzalaceton Benzylidenaceton Methylstyrylketon Benzylidenaceton | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.015.989 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII |
|
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C10H10Ó | |
| Molární hmotnost | 146,19 g / mol |
| Vzhled | světle žlutá pevná látka |
| Hustota | 1,008 g / cm3 |
| Bod tání | 39 až 42 ° C (102 až 108 ° F; 312 až 315 K) |
| Bod varu | 260 až 262 ° C (500 až 504 ° F; 533 až 535 K) |
| 1,3 g / l | |
| Rozpustnost v jiných rozpouštědlech | nepolární rozpouštědla |
| Nebezpečí | |
| Hlavní nebezpečí | dráždivý |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H315, H317, H319, H335 | |
| P261, P264, P271, P272, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P333 + 313, P337 + 313, P362, P363, P403 + 233, P405, P501 | |
| Bod vzplanutí | 116 ° C (241 ° F; 389 K) |
| Související sloučeniny | |
Související sloučeniny | Dibenzylidenaceton cinnamaldehyd |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Benzylidenaceton je organická sloučenina popsáno vzorcem C6H5CH = CHC (O) CH3. Ačkoli oba cis- a trans-izomery jsou možné pro α, β-nenasycené keton je pozorován pouze trans izomer. Jeho původní příprava prokázala rozsah kondenzačních reakcí na konstrukci nových, komplexních organických sloučenin.[1] Benzylidenaceton se používá jako aromatická přísada do potravin a parfémů.[2]
Příprava
Benzylidenaceton lze účinně připravit kondenzací snadno dostupných reagencií vyvolanou NaOH aceton a benzaldehyd:[3]
- CH3C (O) CH3 + C.6H5CHO → C.6H5CH = CHC (O) CH3 + H2Ó

Benzylidenaceton vytvořený touto reakcí však může podstoupit další Claisen-Schmidtova kondenzace s jinou molekulou benzaldehyd tvořit dibenzylidenaceton. Protože relativně slabé báze, jako je NaOH, tvoří velmi málo enolátový ion při rovnováze v reakční směsi stále zbývá hodně nezreagované báze, která může pokračovat a odstraňovat protony z alfa uhlík benzylidenacetonu, což mu umožňuje podstoupit další Claisen-Schmidtovu kondenzaci a vyrobit dibenzylidenaceton.[4]
Pokud na druhou stranu lithium diisopropylamid (LDA) se používá jako báze, veškerý aceton se deprotonuje, čímž se kvantitativně enoluje ion. Nejúčinnějším způsobem výroby benzylidenacetonu je proto použití ekvimolárního množství LDA (v THF), aceton, a benzaldehyd. Reakce musí být provedena bezvodými chemikáliemi, protože LDA se ve vodě rozpadá.[5]
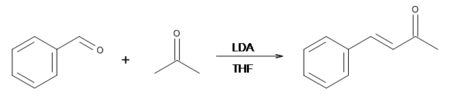
Reakce
Stejně jako u většiny methylketonů je benzylidenaceton na kyselině mírně kyselý alfa pozice, a může být snadno deprotonován za vzniku odpovídajícího izolovat[6]

Sloučenina prochází reakcemi očekávanými pro její shromažďování funkčních skupin: např. Dvojná vazba přidává brom, heterodien přidává elektrony bohaté alkeny v Diels-Alder reakce za vzniku dihydropyrans, methylová skupina se podrobí další kondenzaci s benzaldehydem dibenzylidenaceton a karbonylové formy hydrazony. Reaguje s Fe2(CO)9 dát (benzylidenaceton) Fe (CO)3, činidlo pro přenos Fe (CO)3 jednotku na jiné organické substráty.[7]
- Hydrogenace benzylidenacetonu vede k přípravě benzylaceton.
- Reakce 4-hydroxykumarin s touto sloučeninou výtěžky Warfarin.
Reference
- ^ Claisen, L. "Über die Einwirkung von Aceton auf Furfural und auf Benzaldehyd bei Gegenwart von Alkalilauge" Berichte der deutschen chemischen Gesellschaft 1881, svazek 14, str. 2468-2471.
- ^ Opdyke, D. L. J. (2013). Monografie o vonných surovinách: Sbírka monografií, které se původně objevily v toxikologii pro potraviny a kosmetiku. Elsevier. str. 135. ISBN 9781483147970.
- ^ Drake, N.L .; Allen, Jr. P. "Benzalaceton". Organické syntézy.; Kolektivní objem, 1, str. 77
- ^ Moya-Barrios, R. CHEM 2402 Lab Manual, zima 2016. Dalhousie University, Department of Chemistry
- ^ Bruice, Paula Yurkanis. Organic Chemistry, 7. vydání. Pearson Education, 2014. ISBN 0-321-80322-1
- ^ Danheiser, R. L.; Miller, R. F .; Brisbois, R. G. (1990). „Detrifluoracetylativní přenos skupiny diazo: (E) -1-Diazo-4-fenyl-3-buten-2-on ". Organické syntézy. 73: 134.; Kolektivní objem, 9, str. 197
- ^ Knölker, H.-J. "(η4-Benzylidenaceton) trikarbonyliron "v Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. Onlinedoi:10.1002 / 047084289X.rb058.

