Síran železnatý amonný - Ammonium iron(II) sulfate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Síran železnatý amonný | |
| Ostatní jména Síran amonný železnatý Síran železnatý amonný Mohrova sůl | |
| Identifikátory | |
| |
3D model (JSmol ) | |
| ChEBI |
|
| ChemSpider | |
| Informační karta ECHA | 100.030.125 |
| Číslo ES |
|
PubChem CID | |
| UNII |
|
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Fe (SO4) (NH4)2(TAK4) (bezvodý) Fe (SO4) (NH4)2(TAK4) · 6H2O (hexahydrát) | |
| Molární hmotnost | 284,05 g mol−1 (bezvodý) 392,13 g mol−1 (hexahydrous) |
| Vzhled | Modrozelená pevná látka |
| Hustota | 1,86 g / cm3 |
| Bod tání | 100 až 110 ° C (212 až 230 ° F; 373 až 383 K) |
| Bod varu | Nelze použít |
| 269 g / L (hexahydrát) | |
| Nebezpečí | |
| Bezpečnostní list | Fisher MSDS |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
Související sloučeniny | Síran železnatý amonný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
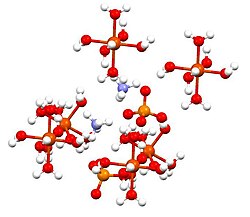
Síran železnatý amonnýnebo Mohrova sůl, je anorganická sloučenina se vzorcem (NH4)2Fe (SO4)2(H2Ó)6. Obsahuje dva různé kationty, Fe2+ a NH4+, je klasifikován jako a podvojná sůl z síran železnatý a síran amonný. Je to běžné laboratorní činidlo, protože snadno krystalizuje a krystaly odolávají oxidaci vzduchem. Stejně jako ostatní soli síranu železnatého se síran železnatý amonný rozpouští ve vodě za vzniku aqua komplex [Fe (H2Ó)6]2+, který má oktaedrická molekulární geometrie.[1] Jeho minerální forma je mohrite.
Struktura
Tato sloučenina je členem skupiny dvojných síranů nazývaných Schönites nebo Tuttonovy soli. Tuttonovy soli tvoří monoklinické krystaly a mají vzorec M.2N (SO4)2.6H2O (M = různé monocations). Pokud jde o vazbu, krystaly sestávají z oktaedra [Fe (H2Ó)6]2+ centra, která jsou vodíkově vázána na síran a amonium.[2]
Mohrova sůl je pojmenována po německém chemikovi Karl Friedrich Mohr, který v 19. století učinil mnoho důležitých pokroků v metodice titrace.
Aplikace
v analytická chemie, tato sůl je preferovaným zdrojem železnatých iontů, protože pevná látka má dlouhou trvanlivost a je odolná vůči oxidaci. Tato stabilita se poněkud rozšiřuje na roztoky odrážející účinek pH na dvojici oxid železitý / železitý. K této oxidaci dochází snadněji při vysokém pH. Amonné ionty způsobují, že roztok Mohrovy soli je mírně kyselý, což zpomaluje tento oxidační proces.[1][3] Kyselina sírová se běžně přidává do roztoků ke snížení oxidace na železité železo.
Používá se v Frickeův dozemetr měřit vysoké dávky gama paprsků.[4]
Příprava
Mohrova sůl se připravuje rozpuštěním ekvimolární směsi hydratovaný síran železnatý a síran amonný ve vodě obsahující trochu kyselina sírová, a poté podrobit výsledek řešení na krystalizace. Síran amonný železnatý tvoří světle zelené krystaly. Tato sůl při zahřátí ionizuje, aby poskytla všechny kationty a anionty přítomné v ní.
Kontaminující látky
Mezi běžné nečistoty patří hořčík, nikl, mangan , Vést, a zinek, z nichž mnohé tvoří izomorfní soli.[5]
Reference
- ^ A b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ^ Ephraim, Fritz (1926). Anorganická chemie. tr P. C. L. Thorne. Londýn: Gurney a Jackson. 484–485.
- ^ „Síran železnatý amonný 100 g (Mohrova sůl)“. 2012. Citováno 13. června 2013.
- ^ Hickman, C .; Lorrain, S .; Barthe, J.R .; Portal, G. (1986). "Použití Mohrovy soli pro vysokou úroveň gama dozimetrie (až 108 Gy) ". Dozimetrie radiační ochrany. Oxfordské časopisy. 17 (1–4): 255–257. doi:10.1093 / oxfordjournals.rpd.a079818.
- ^ Vogel, Arthur I. (1961). Učebnice kvantitativní anorganické analýzy včetně elementární instrumentální analýzy (3. vyd.). Longmans. str. 281–282.

