Hexachloroiridát amonný (IV) - Ammonium hexachloroiridate(IV) - Wikipedia
 | |
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.037.264 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| H8N2Cl6Ir | |
| Molární hmotnost | 441.01 |
| Vzhled | hnědé krystaly |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
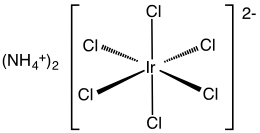
Hexachloroiridát amonný (IV) je anorganická sloučenina se vzorcem (NH4)2[IrCl6]. Tato tmavě hnědá pevná látka je amonný sůl komplexu iridia (IV) [IrCl6]2−. Je to komerčně důležitá sloučenina iridia[1] jeden z nejběžnějších komplexů iridia (IV). Příbuzná, ale špatně definovaná sloučenina je chlorid iridnatý, který se často používá zaměnitelně.[2]
Struktura
Sloučenina byla charakterizována Rentgenová krystalografie. Sůl krystalizuje v kubickém motivu, jako je hexachloroplatinát amonný. [IrCl6]2− centra přijímají oktaedrická molekulární geometrie.[3]
Použití
Je klíčovým meziproduktem při izolaci iridia z rud. Většina ostatních kovů vytváří při zpracování vodných roztoků jejich chloridů nerozpustné sulfidy sirovodík, ale [IrCl6]2− odolává substituci ligandu. Po zahřátí pod vodíkem se pevná sůl přemění na kov:[1]
- (NH4)2[IrCl6] + 2 H2 → Ir + 6 HCl + 2 NH3
Lepení
Elektronická struktura hexachloroiridátu amonného (IV) přitahovala velkou pozornost. Jeho magnetický moment je menší než vypočítaný pro jeden elektron. Tento výsledek je interpretován jako výsledek antiferomagnetického spojení mezi centry Ir zprostředkovanými interakcemi Cl - Cl. Elektronová rezonance spinu Studie ukazují, že více než polovina hustoty odstředění spočívá na chloridu, takže popis komplexu jako Ir (IV) je zjednodušením.[4]
Reference
- ^ A b Renner, H .; Schlamp, G .; Kleinwächter, I .; Drost, E .; Lüschow, H. M .; Tews, P .; Panster, P .; Diehl, M .; et al. (2002). "Kovy a sloučeniny platinové skupiny". Ullmann's Encyclopedia of Industrial Chemistry. Wiley. doi:10.1002 / 14356007.a21_075.
- ^ Thomas R. B. Mitchell (2001). „Iridium (IV) Chloride“. e-EROS Encyclopedia of Reagents for Organic Synthesis. doi:10.1002 / 047084289X.ri050.
- ^ Bokii, GB; Ussikov, P.I. „Roentgenographische Untersuchung der Struktur des Ammonium-Chlor-Iridats (N H4)2IrCl6 Doklady Akademii Nauk SSSR 1940, roč. 26, p782-p784.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemie prvků (2. vyd.). Butterworth-Heinemann. str. 1121. ISBN 978-0-08-037941-8.
