Allyl-acetát - Allyl acetate
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC Prop-2-en-l-ylacetát | |
| Ostatní jména 2-propenylacetát Allyl-acetát | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.008.851 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 2333 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C5H8Ó2 | |
| Molární hmotnost | 100.117 g · mol−1 |
| Vzhled | Bezbarvá kapalina |
| Hustota | 0,928 g / cm3 |
| Bod varu | 103 ° C (217 ° F; 376 K) |
| málo rozpustný | |
| -56.7·10−6 cm3/ mol | |
| Nebezpečí | |
| Piktogramy GHS |    |
| Signální slovo GHS | Nebezpečí |
| H225, H301, H312, H319, H330 | |
| P210, P233, P240, P241, P242, P243, P260, P264, P270, P271, P280, P284, P301 + 310, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P312, P320, P321, P322, P330, P337 + 313, P363 | |
| 374 ° C (705 ° F; 647 K) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Allyl-acetát je organická sloučenina se vzorcem C.3H5OC (O) CH3. Tato bezbarvá kapalina je zejména předchůdcem allylalkohol, což je užitečný průmyslový meziprodukt. To je acetát ester allylalkoholu.
Příprava
Allylacetát se průmyslově vyrábí reakcí v plynné fázi propen v přítomnosti octová kyselina používat palladium katalyzátor:[1][2]
- C3H6 + CH3COOH + ½ O2 → CH2= CHCH2OCOCH3 + H2Ó
Tato metoda je výhodná, protože propen je levný a „zelená „Allylalkohol se také vyrábí primárně z allylchloridu, ale výroba hydrolýzou allylacetátu se vyhýbá použití chloru, a proto se jeho použití zvyšuje.
Vinylacetát se vyrábí podobně, za použití ethylen místo propenu. Tyto reakce jsou příklady acetoxylace. Palladiové centrum je poté znovu oxidováno O2 současnost, dárek. Mechanismus acetoxylace sleduje podobnou cestu, kdy propen vytváří na palladiu vazbu π-alyl.[3]
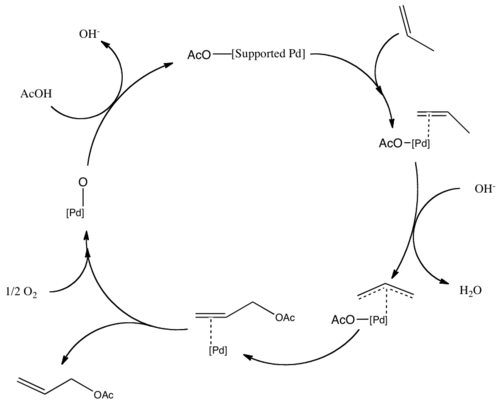 Katalytický cyklus pro výrobu alyl-acetátu.
Katalytický cyklus pro výrobu alyl-acetátu.
Reakce a aplikace
Allylacetát lze hydrolyzovat na allylalkohol:
- CH2= CHCH2OCOCH3 + H2O → CH2= CHCH2OH + CH3COOH
Allylalkohol je předchůdcem některých speciálních polymerů, zejména pro sušící oleje. Allylalkohol je také předchůdcem syntetických látek glycerol. Epoxidace o peroxid vodíku vyrábí glycidol, který podléhá hydrolýze na glycerol.
- CH2= CHCH2OH + HOOH → CH2OCHCH2OH + H2Ó
- CH2OCHCH2OH + H2O → C.3H5(ACH)3
Syntetický glycerol má tendenci se používat v kosmetice a toaletních potřebách, zatímco glycerol z hydrolýzy tuků se používá v potravinách.[4]
Substituční reakce
Substituce acetátové skupiny v allylacetátu za použití výtěžků chlorovodíku allylchlorid. Reakce s kyanovodík nad výtěžky měděného katalyzátoru allylkyanid.[5]
- CH2= CHCH2OCOCH3 + HCl → CH2= CHCH2Cl + CH3COOH
- CH2= CHCH2OCOCH3 + HCN → CH2= CHCH2CN + CH3COOH
Allylchlorid se obecně vyrábí přímo chlorací propenu.
Reference
- ^ Harold Wittcoff; B. G. Reuben; Jeffrey S. Plotkin (2004). Průmyslové organické chemikálie (Knihy Google výňatek). str. 212. ISBN 978-0-471-54036-6.
- ^ Ludger Krähling; Jürgen Krey; Gerald Jakobson; Johann Grolig; Leopold Miksche (2002). "Allylové sloučeniny". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a01_425. ISBN 978-3527306732.
- ^ M. R. Churchill; R. Mason (1964). "Molekulární struktura octanu π-allyl-palladia". Příroda. 4960 (4960): 777. doi:10.1038 / 204777a0.
- ^ H. A. Wittcoff; B. G. Reuben; J. S. Plotkin (2004). "Chemikálie a polymery z propylenu". Průmyslové organické chemikálie. str.195 –214. ISBN 978-0-471-44385-8.
- ^ Ludger Krahling; et al. (2000). "Allylové sloučeniny". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a01_425.

