Aleksandr Dianin - Aleksandr Dianin - Wikipedia
Aleksandr Dianin | |
|---|---|
 | |
| narozený | 20. dubna 1851 |
| Zemřel | 6. prosince 1918 (ve věku 67) |
| Národnost | ruština |
| Alma mater | Univerzita v Jeně (PhD in Chemistry, 1877) Imperial Medical-Surgical Academy in St. Petersburg (MD, 1882) |
| Známý jako | Bisfenol A Dianinova sloučenina |
| Vědecká kariéra | |
| Pole | Organická chemie |
| Instituce | Imperial Medical-Surgical Academy in St. Petersburg |
| Vlivy | Alexander Borodin Nikolay Zinin |
| Ovlivněno | Phoebus Levene[1] |
Aleksandr Pavlovič Dianin (ruština: Александр Павлович Дианин; 20. dubna 1851 - 6. prosince 1918) byl a ruština chemik z Petrohrad. Provedl studie o fenoly a objevil fenol derivát nyní známý jako bisfenol A[2][3] a podle toho pojmenované Dianinova sloučenina.[4] Byl ženatý s adoptivní dcerou chemičky Alexander Borodin. V roce 1887 nastoupil Dianin po svém tchánovi jako předseda chemického oddělení na Imperial Medical-Surgical Academy v Petrohradě (nyní S.M. Kirovova vojenská lékařská akademie ).
Bisfenol A a Dianinova sloučenina
Dianinova metoda přípravy bisfenol A z roku 1891[2] zůstává nejznámějším přístupem k této důležité složce,[5] ačkoli tato metoda byla zdokonalena pro syntézu v průmyslovém měřítku.[6] Zahrnuje to katalyzovaný kondenzace směsi 2: 1 fenol a aceton v přítomnosti koncentrovaného kyselina chlorovodíková nebo kyselina sírová. Reakce probíhá snadno při teplotě místnosti a vytváří se surový produkt obsahující širokou škálu vedlejších produktů (včetně Dianinova sloučenina ) během několika hodin.[5] Celková rovnice je jednoduchá, pouze voda vedlejší produkt:
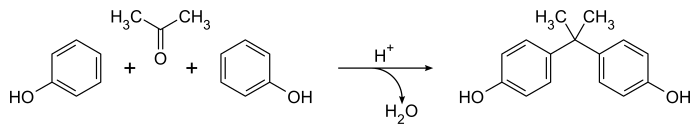
Kyselý katalyzátor mechanicky převádí aceton na a karbeniový ion který prochází elektrofilní aromatická substituce reakce s fenolem, produkující převážně odst- substituovaný produkty. Druhý karbeniový druh je produkován protonací a ztrátou alifatické látky hydroxyl skupina, vedoucí k bisfenolu A (4,4'-isopropylidendifenol) po druhé aromatické substituční reakci. Proces není příliš selektivní a je známo velké množství vedlejších produktů a vedlejších reakcí.[5]

Vedlejší produkty, které jsou izomery bisfenolu A vznikající při tvorbě ortho-substituované produkty, a zahrnují 2,2'- a 2,4'- izomery isopropylidendifenolu. Mezi další vedlejší reakce patří tvorba trifenol I, 4,4 '- (4-hydroxy-m-fenylendiisopropyliden) difenol, z ataku karbenia elektrofil na molekule bisfenolu A a tvorbě trifenol II, 4,4 ', 4' '- (2-methyl-2-pentanyl-4-yliden) trifenol, pokud eliminační reakce převádí karbenium na reaktivní olefin.[5] Katalyzovaný dimerizace acetonu přes kondenzace aldolu je dobře známo a výnosů diaceton alkohol a (podle dehydratace ) mesityloxid v obou kyselých[7] a základní podmínky.[8][9] The in situ generace mesityloxidu přidává ke směsi další reaktivní olefin. V případech, kdy olefinik skupina může interagovat s fenolovou hydroxylovou skupinou (obvykle jako výsledek ortho-substituce), rychlé cyklizace vyvolávající reakce flavany a chromany nastat.[5] Toto je zdroj Dianinovy sloučeniny ve směsi a Dianin následně prokázal, že sloučenina může být vyrobena v mnohem větším výtěžku přímou reakcí fenolu s mesityloxidem.[4] Pozdější práce ukázaly, že výroba bisfenolu A může být mnohem selektivnější použitím reakční směsi se značným přebytkem fenolu než s stechiometrický Složení 2: 1, což výrazně potlačuje vedlejší reakce.[6]
Reference
- ^ Tipson, R. Stuart (1957). Wolfrom, M. L. (vyd.). Phoebus Aaron Theodore Levene: 1869–1940. Nekrolog. Pokroky v chemii sacharidů. 12. New York: Academic Press. s. 1–12. ISBN 9780080562711.
- ^ A b Dianin, A. P. (1891). „О продуктах конденсации кетонов с фенолами“ [Kondenzace ketonů fenoly]. Журнал Русского Физико-Химического Общества (J. Russ. Phys. Chem. Soc.) (v Rusku). 23: 488–517, 523–546, 601–611.
- ^ Zincke, Theodor (1905). „Ueber die Einwirkung von Brom und von Chlor auf Phenole: Substitutionsprodukte, Pseudobromide und Pseudochloride“ [O vlivu bromu a chloru na fenoly: Substituční produkty, pseudobromidy a pseudochloridy]. Justus Liebigs Annalen der Chemie (v němčině). 343: 75–99. doi:10,1002 / jlac.19053430106.
- ^ A b Dianin, A. P. (1914). "Kondenzace fenolu s nenasycenými ketony. Kondenzace fenolu s mesityloxidem". Журнал Русского Физико-Химического Общества (J. Russ. Phys. Chem. Soc.) (v Rusku). 36: 1310–1319.
- ^ A b C d E McKetta, John J., vyd. (1977). „Bisfenol A“. Asfaltová emulze k míchání. Encyclopedia of Chemical Processing and Design. 4. Marcel Dekker. 406–430. ISBN 9780824724542.
- ^ A b Fiege, Helmut; Voges, Heinz-Werner; Hamamoto, Toshikazu; Umemura, Sumio; Iwata, Tadao; Miki, Hisaya; Fujita, Yasuhiro; Buysch, Hans-Josef; Garbe, Dorothea; Paulus, Wilfried (2000). "Fenolové deriváty". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a19_313. ISBN 3527306730.
- ^ Weissermel, Klaus; Arpe, Hans-Jürgen (2003). „Sekundární produkty acetonu“. Průmyslová organická chemie (4. vydání). John Wiley & Sons. 281–288. ISBN 9783527305780.
- ^ Conant, James B.; Tuttle, Neal (1921). „Diacetonalkohol (2-pentan, 4-hydroxy-4-methyl)“. Org. Synth. 1: 45. doi:10.15227 / orgsyn.001.0045.; Sb. Sv., 1, str. 199
- ^ Conant, James B.; Tuttle, Neal (1921). „Mesityl Oxide“. Org. Synth. 1: 53. doi:10.15227 / orgsyn.001.0053.; Sb. Sv., 1, str. 345
Další čtení
- Dianin, Sergey Aleksandrovich (1980). Borodin. Westport: Greenwood Press. ISBN 9780313225291. OCLC 247826062.
- Figurovskij, Nikolay Aleksandrovich; Solovjev, Jurij Ivanovič (1988). Aleksandr Porfirievich Borodin: biografie chemika. New York: Springer-Verlag. p. 22. ISBN 9780387178882. OCLC 16647830.
