Nulová iontová vrstva - Zero ionic layer
Nulová iontová vrstva je hlavním místem interakce v základní komplex SNARE. Interakce dipól-dipól proběhne mezi 3 glutamin (Q) zbytky a 1 arginin (R) zbytek vystavený v této vrstvě. Navzdory tomu je většina komplexu SNARE hydrofobní kvůli leucinovému zipu.[1] Rozsáhle studované vrstvy v rámci svazku alfa-šroubovic SNARE jsou označeny od „-7“ do „+8“. Nulová iontová vrstva je ve středu svazku a je tedy označena jako „0“ vrstva.[2]
Struktura
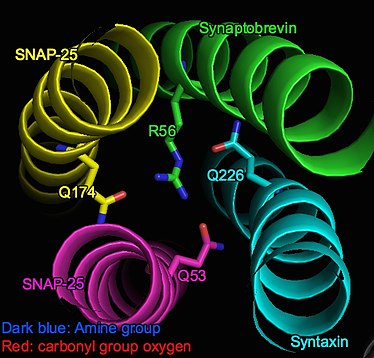
Komplex SNARE je svazek tvořený 4 alfa-helikálními proteiny, včetně váček - přidružené Synaptobrevin asociované s buněčnou membránou Syntaxin a SNAP.[3] Při pohledu na svazek na boku tvoří alfa uhlíky z každé šroubovice každou rovinu, která je takto označena jako „vrstva“. Podél spirálového svazku od N-konce k C-konci jsou vrstvy označeny od „-7“ do „+8“. "0" vrstva (tj. Nulová iontová vrstva) je ve středu spirálového svazku.[2][4]
Nulová iontová vrstva je iontová doména v jinak převážně hydrofobním alfa-helikálním komplexu (SNARE komplex). Je stabilizován přitažlivými silami (dipól-dipól interakce) mezi třemi částečně záporně nabitými karbonylové skupiny z glutamin zbytky a kladně nabité arginin.[5] Konkrétně tyto interagující skupiny zahrnují Q226 Syntaxin, Q53 zapnuto SNAP-25 (Sn1), Q174 na SNAP-25 (Sn2) a R56 na Synaptobrevin (v-SNARE).[1]
4 aminokyseliny jsou ve vrstvě asymetricky uspořádány, jak je znázorněno na obrázku. Jejich intenzivní interakce však zajišťují stabilitu vrstvy: konec postranního řetězce argininu leží ve středu asymetrie a aminoskupiny tvoří vodíkové vazby se třemi glutaminovými zbytky. Sterické a elektrostatické uložení je tedy dobře zavedené.[6]
Funkce a výzkumný zájem
SNARE proteiny jsou rodinou proteinů, které se nacházejí v buněčné membrány zprostředkovat jakékoli sekreční cesty.[7] Komplex se tvoří během exocytóza, proces, při kterém se vezikuly uvnitř buňky spojují s buněčná membrána vylučovat molekuly do extracelulárního prostoru.[3][8]
Nulová iontová vrstva komplexu SNARE je předmětem zvláštního zájmu vědců studujících SNARE kvůli jeho třem charakteristikám. Za prvé je to jediná hydrofilní oblast v celém hydrofobním komplexu SNARE; za druhé, na rozdíl od většiny ostatních vrstev zobrazuje asymetrii; za třetí, uspořádání 3Q: 1R se nachází téměř v celé nadrodině SNARE mezi eukaryotickými buňkami.[6][4] Tyto jedinečné aspekty naznačují jeho význam pro eukaryotické organismy obecně. Přesná funkce a funkce nulové iontové vrstvy je však stále předmětem výzkumu.[6][2]
Předchozí studie se zaměřily na to, jak by mutace v této vrstvě ovlivnily funkčnost komplexu SNARE v sekrečních cestách. I když přesný mechanismus stále čeká na další zkoumání, tyto studie odhalily, že integrita nulové iontové vrstvy není nezbytná pro správné zarovnání během tvorby komplexu, ale je nezbytná pro disociaci komplexu SNARE a recyklaci jeho 4 složek alfa -helikální proteiny po exocytóze.[1][6]
An ATPáza (NSF) společně s a kofaktor (α-SNAP) usnadňuje rozpad komplexu SNARE po dokončení exocytózy.[9] Studie naznačují, že během procesu disociace komplex NSF / α-SNAP působí specificky na nulovou iontovou vrstvu, zejména na glutaminový zbytek (Q226) v Syntaxinu. Glutaminový zbytek přenáší konformační změnu komplexu NSF / a-SNAP na komplex SNARE, aby narušil a tím disocioval komplex SNARE na nulové iontové vrstvě.[1][6] Přesněji řečeno, i když je iontová vrstva z větší části pohřbena v hydrofobním komplexu, během disociace může komplex NSF / a-SNAP narušit hydrofobní stínění a tím propustit molekuly vody do jádra. Tato expozice dalším hydrofilním molekulám narušuje původní rovnováhu vodíkových vazeb a tím usnadňuje demontáž alfa-helikálního svazku.[4]
Mutace a střídání
Ve studiích, které jako modely používají exocytotické SNARE kvasinek, vede mutace od glutaminu k argininu v nulové iontové vrstvě k kvasinkovým buňkám, které mají nedostatečný růst a schopnost sekrece bílkovin. Mutace z argininu na glutamin v této vrstvě však vede k kvasinkovým buňkám, které jsou funkčně divokého typu.[6] V mutaci, kde jsou všechny čtyři aminokyseliny v nulové iontové vrstvě zbytky glutaminu, buňky stále vykazují normální sekreční schopnost, ale mohou existovat výrazné defekty, pokud existují další mutace.[10]
Doplňkové mutace, kde je mutace glutaminu na arginin spárována s mutací argininu na glutamin v nulové iontové vrstvě, vedly podle jejich sekreční schopnosti také k funkčním buňkám divokého typu.[11]
Tyto mutační studie byly provedeny za účelem studia role čtyř aminokyselin v nulové iontové vrstvě. Základní mechanismy, proč by tyto mutace vedly k určitým výsledkům, nejsou dobře diskutovány. Obecně mají glutaminové zbytky v této vrstvě zásadní význam pro funkčnost mutovaných kmenů. Pokud je glutamin během mutace neporušený nebo je nějakým způsobem kompenzován, funkčnost komplexu SNARE zůstane zachována.[6][10][11]
Reference
- ^ A b C d Scales, Suzie J .; Yoo, Bryan Y .; Scheller, Richard H. (12.12.2001). „Iontová vrstva je nutná pro účinnou disociaci komplexu SNARE α-SNAP a NSF“. Sborník Národní akademie věd. 98 (25): 14262–14267. doi:10.1073 / pnas.251547598. ISSN 0027-8424. PMC 64670. PMID 11762430.
- ^ A b C Fasshauer, D .; Sutton, R. B .; Brunger, A. T .; Jahn, R. (1998-12-22). „Zachované strukturální rysy synaptického fúzního komplexu: proteiny SNARE překlasifikovány na Q- a R-SNARE“. Sborník Národní akademie věd Spojených států amerických. 95 (26): 15781–15786. doi:10.1073 / pnas.95.26.15781. ISSN 0027-8424. PMC 28121. PMID 9861047.
- ^ A b Hanson, P. I .; Heuser, J. E.; Jahn, R. (červen 1997). "Uvolnění neurotransmiteru - čtyři roky komplexů SNARE". Aktuální názor v neurobiologii. 7 (3): 310–315. doi:10.1016 / s0959-4388 (97) 80057-8. ISSN 0959-4388. PMID 9232812.
- ^ A b C Sutton, R. B .; Fasshauer, D .; Jahn, R .; Brunger, A. T. (1998-09-24). „Krystalová struktura komplexu SNARE zapojeného do synaptické exocytózy při rozlišení 2,4 A“. Příroda. 395 (6700): 347–353. doi:10.1038/26412. ISSN 0028-0836. PMID 9759724.
- ^ McMahon, Harvey T .; Südhof, Thomas C. (03.02.1995). „Synaptický jádrový komplex synaptobrevinu, syntaxinu a SNAP25 tvoří vysoce afinitní vazebný web SNAP“. Journal of Biological Chemistry. 270 (5): 2213–2217. doi:10.1074 / jbc.270.5.2213. ISSN 0021-9258. PMID 7836452.
- ^ A b C d E F G Ossig, Rainer; Schmitt, Hans Dieter; Groot, Bert de; Riedel, Dietmar; Keränen, Sirkka; Ronne, Hans; Grubmüller, Helmut; Jahn, Reinhard (2000-11-15). „Exocytóza vyžaduje asymetrii v centrální vrstvě komplexu SNARE“. Časopis EMBO. 19 (22): 6000–6010. doi:10.1093 / emboj / 19.22.6000. ISSN 0261-4189. PMC 305815. PMID 11080147.
- ^ Götte, M (1998). "Nový rytmus pro buben SNARE". Trendy v buněčné biologii. 8 (6): 215–218. doi:10.1016 / s0962-8924 (98) 01272-0.
- ^ Söllner, Thomas; Whiteheart, Sidney W .; Brunner, Michael; Erdjument-Bromage, Hediye; Geromanos, Scott; Tempst, Paul; Rothman, James E. (březen 1993). "SNAP receptory zapojené do cílení a fúze vezikul". Příroda. 362 (6418): 318–324. doi:10.1038 / 362318a0. ISSN 1476-4687.
- ^ Chang, Sunghoe; Girod, Romain; Morimoto, Takako; O’Donoghue, Michael; Popov, Sergey (1998). „Konstitutivní sekrece exogenního neurotransmiteru neuronálními buňkami: důsledky pro neuronální sekreci“. Biofyzikální deník. 75 (3): 1354–1364. doi:10.1016 / s0006-3495 (98) 74053-6. PMC 1299809. PMID 9726936.
- ^ A b Katz, L .; Brennwald, P. (listopad 2000). „Testování pravidla„ 3Q: 1R “: mutační analýza iontové„ nulové “vrstvy v kvasinkovém exocytovém komplexu SNARE neodhalila žádný požadavek na arginin.“. Molekulární biologie buňky. 11 (11): 3849–3858. doi:10,1091 / mbc.11.11.3849. ISSN 1059-1524. PMC 15041. PMID 11071911.
- ^ A b Graf, Carmen T .; Riedel, Dietmar; Schmitt, Hans Dieter; Jahn, Reinhard (2005-05-01). "Identifikace funkčně interagujících SNARE pomocí doplňkových substitucí v konzervované vrstvě" 0 "". Molekulární biologie buňky. 16 (5): 2263–2274. doi:10.1091 / mbc.e04-09-0830. ISSN 1059-1524. PMC 1087233. PMID 15728725.
