Fosfatáza citlivá na napětí - Voltage sensitive phosphatase
Fosfatázy citlivé na napětí nebo fosfatázy obsahující senzor napětí, běžně zkráceno VSP, plocha rodina bílkovin nalezený v mnoha druzích, včetně lidí, myší, zebrafish, žab a mořských prcek.

| Identifikátory | |
|---|---|
| Symbol | VSP |
| OPM nadčeleď | 447 |
| OPM protein | 4g80 |
Objev
První napěťově citlivá fosfatáza byla objevena jako výsledek průzkumu v celém genomu v mořská stříkačka Ciona intestinalis.[1] Hledání bylo navrženo k identifikaci proteinů, které obsahovaly sekvenci aminokyseliny volal a napěťový senzor, protože tato sekvence aminokyselin propůjčuje citlivost na napětí napěťově řízené iontové kanály.[2][3][4] Ačkoli se počáteční genomická analýza primárně zabývala vývojem napěťově řízených iontových kanálů, jedním z výsledků práce byl objev proteinu VSP v mořské stříkačce, nazývané Ci-VSP.[5]
Homology s Ci-VSP u savců se nazývají Transmembránové fosfatázy s homologií tenzinunebo TPTE. TPTE (nyní také hVSP2[6]) a úzce související TPIP (také nazývaný TPTE2 nebo hVSP1[7]) byly identifikovány před objevením Ci-VSP,[8][9][10][11] v počátečních zprávách o těchto proteinech však nebyla popsána žádná aktivita závislá na napětí. Následně byly použity výpočetní metody, které naznačují, že tyto proteiny mohou být citlivé na napětí,[12] nicméně Ci-VSP je stále široce považován za první identifikovaný VSP.[13][14]
Distribuce druhů a tkání
VSP se vyskytují u zvířat a choanoflagellates, ačkoli ztracen z hlístic a hmyzu.[15] Lidé mají dva členy, TPTE a TPTE2, které jsou výsledkem duplikace specifické pro primáty [1]. Většina zpráv naznačuje, že VSP se nacházejí především v reprodukční tkáni, zejména ve varlatech. Mezi další objevené VSP patří: Dr-VSP (zebrafish Danio rerio, 2008),[16] Gg-VSP (kuře Gallus gallus domesticus, 2014),[17] Xl-VSP1, Xl-VSP2 a Xt-VSP (žáby: X. laevis a X. tropicalis, 2011),[18] TPTE (myš),[19] atd.
Po objevení Ci-VSP se nomenklatura používaná pro pojmenování těchto proteinů skládá ze dvou písmen odpovídajících iniciálám názvu druhu, následovaná zkratkou VSP. U lidských VSP bylo navrženo přijetí názvů Hs-VSP1 a Hs-VSP2, pokud jde o TPIP, respektive TPTE[14][20].
Struktura a funkce
VSP se skládají ze dvou proteinové domény: doména snímače napětí a fosfatáza doména spojená s doménou C2 vázající lipidy.
Senzor napětí

Doména napěťového senzoru obsahuje čtyři transmembránové šroubovice, pojmenované S1 až S4. Transmembránová šroubovice S4 obsahuje řadu pozitivně nabitých argininových a lysinových aminokyselinových zbytků. Citlivost napětí ve VSP je generována primárně těmito náboji v S4, podobně jako jsou napěťově řízené iontové kanály napájeny napětím. Když kladný náboj hromadí se na jedné straně membrány obsahující takové napěťové senzory, generuje elektrickou sílu tlačící S4 v opačném směru. Změny v membránovém potenciálu proto pohybují S4 tam a zpět přes membránu, což umožňuje senzoru napětí působit jako spínač. K aktivaci napěťového senzoru dochází u depolarizovaných potenciálů, tj. Když membrána shromažďuje na vnitřním letáku více kladného náboje. Naopak k deaktivaci snímače napětí dochází u hyperpolarizovaných potenciálů, kdy membrána shromažďuje více negativního náboje na vnitřním letáku. Aktivace napěťového senzoru zvyšuje aktivitu fosfatázové domény, zatímco deaktivace napěťového senzoru snižuje aktivitu fosfatázy.
Fosfatáza
Fosfatázová doména ve VSP je vysoce homologní s supresor nádoru PTEN a působí na odstranění fosfátových skupin z fosfolipidy v membráně obsahující VSP. Fosfolipidy, jako jsou inositolfosfáty, jsou signální molekuly, které mají různé účinky v závislosti na vzoru, ve kterém jsou fosforylovány a defosforylovány. Působením VSP je tedy nepřímá regulace procesů závislých na fosfolipidech.
Hlavní substrát, který byl dosud charakterizován pro VSP (včetně hVSP1[21] ale ne hVSP2 /TPTE, který nevykazuje žádnou aktivitu fosfatázy) je fosfatidylinositol (4,5) -bisfosfát, které VSP defosforylují v poloze 5 '.[22][23] Aktivita VSP však byla hlášena proti jiným fosfoinositidy také, včetně fosfatidylinositol (3,4,5) -trifosfát, který je také defosforylován v poloze 5 '.[24] Aktivita proti 3-fosfátu z PI (3,4) P2 bylo rovněž prokázáno; tato aktivita se zdá být zřejmá při vysokých membránových potenciálech, při nižších potenciálech převládá aktivita 5'-fosfatázy.[25]
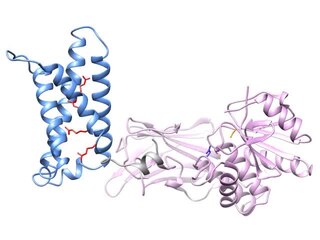
Rentgenové krystalové struktury
Rentgenová krystalografie byl použit ke generování obrázků ve vysokém rozlišení dvou domén Ci-VSP, oddělených od sebe navzájem.[26][27][28] Zavedením malých mutací v proteinu vytvořili vědci krystalovou strukturu jak domény snímající napětí, tak domény fosfatázy z Ci-VSP ve stavech „zapnuto“ a „vypnuto“. Tyto struktury vedly k modelu aktivace VSP, kde pohyb snímače napětí ovlivňuje konformační změnu ve "hradlové smyčce", čímž se glutamátový zbytek ve hradlové smyčce pohybuje od katalytické kapsy fosfatázové domény, aby se zvýšila aktivita fosfatázy.
Využití ve výzkumu a v biologii
VSP byly použity jako nástroj pro manipulaci s fosfolipidy v experimentálním prostředí. Protože membránový potenciál lze ovládat pomocí svorka techniky, umístění VSP v membráně umožňuje experimentátorům rychle defosforylovat substráty VSP. Napěťové senzory VSP byly také použity pro konstrukci geneticky kódovatelných napěťově citlivých fluorescenčních sond. Tyto sondy umožňují experimentátorům vizualizovat napětí v membránách pomocí fluorescence. Normální role, kterou VSP hrají v těle, však stále není dobře pochopena.
Viz také
Reference
- ^ Okamura Y, Nishino A, Murata Y, Nakajo K, Iwasaki H, Ohtsuka Y, Tanaka-Kunishima M, Takahashi N, Hara Y, Yoshida T, Nishida M, Okado H, Watari H, Meinertzhagen IA, Satoh N, Takahashi K, Satou Y, Okada Y, Mori Y (srpen 2005). „Komplexní analýza ascidiánského genomu odhaluje nové poznatky o molekulární evoluci genů iontových kanálů“. Fyziologická genomika. 22 (3): 269–82. doi:10.1152 / physiolgenomics.00229.2004. PMID 15914577.
- ^ Liman ER, Hess P, Weaver F, Koren G (říjen 1991). "Zbytky snímající napětí v oblasti S4 savčího kanálu K +". Příroda. 353 (6346): 752–6. Bibcode:1991 Natur.353..752L. doi:10.1038 / 353752a0. PMID 1944534. S2CID 4372265.
- ^ Papazian DM, Timpe LC, Jan YN, Jan LY (leden 1991). "Změna napěťové závislosti Shakerova draslíkového kanálu mutacemi v sekvenci S4". Příroda. 349 (6307): 305–10. Bibcode:1991 Natur.349..305P. doi:10.1038 / 349305a0. PMID 1846229. S2CID 4239823.
- ^ Shao XM, Papazian DM (srpen 1993). „Mutace S4 mění kinetiku jednokanálového hradlování kanálů Shaker K +“. Neuron. 11 (2): 343–52. doi:10.1016 / 0896-6273 (93) 90189-X. PMID 8352942. S2CID 26474737.
- ^ Murata Y, Iwasaki H, Sasaki M, Inaba K, Okamura Y (červen 2005). "Aktivita fosfoinositid fosfatázy spojená se senzorem vnitřní napětí". Příroda. 435 (7046): 1239–43. Bibcode:2005 Natur.435.1239M. doi:10.1038 / nature03650. PMID 15902207. S2CID 4427755.
- ^ Halaszovich CR, Leitner MG, Mavrantoni A, Le A, Frezza L, Feuer A, Schreiber DN, Villalba-Galea CA, Oliver D (listopad 2012). „Lidská fosfolipid fosfatáza aktivovaná transmembránovým řídicím modulem“. Journal of Lipid Research. 53 (11): 2266–74. doi:10.1194 / ml. M026021. PMC 3465996. PMID 22896666.
- ^ Halaszovich CR, Leitner MG, Mavrantoni A, Le A, Frezza L, Feuer A, Schreiber DN, Villalba-Galea CA, Oliver D (listopad 2012). „Lidská fosfolipid fosfatáza aktivovaná transmembránovým řídicím modulem“. Journal of Lipid Research. 53 (11): 2266–74. doi:10.1194 / ml. M026021. PMC 3465996. PMID 22896666.
- ^ Guipponi, M .; Tapparel, C .; Jousson, O .; Scamuffa, N .; Mas, C .; Rossier, C .; Hutter, P .; Meda, P .; Lyle, R. (2001-12-01). „Myší ortolog proteinu TPTE lokalizovaného v Golgi poskytuje vodítka k evoluční historii lidské rodiny genů TPTE“ (PDF). Genetika člověka. 109 (6): 569–575. doi:10,1007 / s004390100607. ISSN 0340-6717. PMID 11810268. S2CID 8267495.
- ^ Walker SM, Downes CP, Leslie NR (prosinec 2001). „TPIP: nová fosfoinositid 3-fosfatáza“. The Biochemical Journal. 360 (Pt 2): 277–83. doi:10.1042/0264-6021:3600277. PMC 1222227. PMID 11716755.
- ^ Wu, Y .; Dowbenko, D .; Pisabarro, M. T .; Dillard-Telm, L .; Koeppen, H .; Lasky, L. A. (2001-06-15). „PTEN 2, homolog specifický pro varlata související s Golgiho PTEN tumor supresor lipid fosfatázy“. The Journal of Biological Chemistry. 276 (24): 21745–21753. doi:10,1074 / jbc.M101480200. ISSN 0021-9258. PMID 11279206.
- ^ Chen, H .; Rossier, C .; Morris, M. A .; Scott, H. S .; Gos, A .; Bairoch, A .; Antonarakis, S.E. (01.01.1999). „Specifický gen pro varlata, TPTE, kóduje domnělou transmembránovou tyrosin fosfatázu a mapuje pericentromerickou oblast lidských chromozomů 21 a 13 a chromozomů 15, 22 a Y“. Genetika člověka. 105 (5): 399–409. doi:10.1007 / s004390051122. ISSN 0340-6717. PMID 10598804.
- ^ Kumánovics, Attila; Levin, Gal; Blount, Paul (01.10.2002). "Rodinné vazby bránových pórů: vývoj modulu snímače". FASEB Journal. 16 (12): 1623–1629. doi:10.1096 / fj.02-0238hyp. ISSN 1530-6860. PMID 12374785.
- ^ Okamura Y, Murata Y, Iwasaki H (únor 2009). "Fosfatáza snímající napětí: akce a potenciály". The Journal of Physiology. 587 (3): 513–20. doi:10.1113 / jphysiol.2008.163097. PMC 2670076. PMID 19074969.
- ^ A b Villalba-Galea CA (2012). „Enzymy řízené napětím: Nový JanusBifrons“. Hranice ve farmakologii. 3: 161. doi:10.3389 / fphar.2012.00161. PMC 3440755. PMID 22993507.
- ^ Chen, Mark J .; Dixon, Jack E .; Manning, Gerard (11.04.2017). "Genomika a vývoj proteinových fosfatáz". Vědecká signalizace. 10 (474): eaag1796. doi:10.1126 / scisignal.aag1796. ISSN 1937-9145. PMID 28400531. S2CID 41041971.
- ^ Hossain, Md Israil; Iwasaki, Hirohide; Okochi, Yoshifumi; Chahine, Mohamed; Higashijima, Shinichi; Nagayama, Kuniaki; Okamura, Yasushi (2008-06-27). „Enzymová doména ovlivňuje pohyb snímače napětí ve fosfatázách snímajících napětí ascidian a zebrafish“. The Journal of Biological Chemistry. 283 (26): 18248–18259. doi:10,1074 / jbc.M706184200. ISSN 0021-9258. PMID 18375390.
- ^ Yamaguchi, Shinji; Aoki, Naoya; Kitajima, Takaaki; Okamura, Yasushi; Homma, Koichi J. (01.10.2014). "Exprese genu pro fosfatázu snímajícího napětí v embryonálních tkáních kuřat a v mozečku dospělého". Komunikativní a integrativní biologie. 7 (5): e9705021. doi:10.4161/19420889.2014.970502. PMC 4594614. PMID 26843905.
- ^ Ratzan, William J .; Evsikov, Alexej V .; Okamura, Yasushi; Jaffe, Laurinda A. (2011-11-01). „Napěťově citlivé fosfoinositid fosfatázy z Xenopus: jejich tkáňová distribuce a závislost na napětí“. Journal of Cellular Physiology. 226 (11): 2740–2746. doi:10,1002 / jcp.22854. ISSN 1097-4652. PMC 3181042. PMID 21618529.
- ^ "Tpte - MCG118205, izoforma CRA_c - Mus musculus (myš) - gen a protein Tpte". www.uniprot.org. Citováno 2017-05-11.
- ^ Okamura, Yasushi; Kawanabe, Akira; Kawai, Takafumi (10 01, 2018). „Fosfatázy snímající napětí: biofyzika, fyziologie a molekulární inženýrství“. Fyziologické recenze. 98 (4): 2097–2131. doi:10.1152 / physrev.00056.2017. ISSN 1522-1210. PMID 30067160. Zkontrolujte hodnoty data v:
| datum =(Pomoc) - ^ Halaszovich CR, Leitner MG, Mavrantoni A, Le A, Frezza L, Feuer A, Schreiber DN, Villalba-Galea CA, Oliver D (listopad 2012). „Lidská fosfolipid fosfatáza aktivovaná transmembránovým řídicím modulem“. Journal of Lipid Research. 53 (11): 2266–74. doi:10.1194 / ml. M026021. PMC 3465996. PMID 22896666.
- ^ Iwasaki H, Murata Y, Kim Y, Hossain MI, Worby CA, Dixon JE, McCormack T, Sasaki T, Okamura Y (červen 2008). „Fosfatáza snímající napětí, Ci-VSP, která sdílí sekvenční identitu s PTEN, defosforyluje fosfatidylinositol 4,5-bisfosfát“. Sborník Národní akademie věd Spojených států amerických. 105 (23): 7970–5. Bibcode:2008PNAS..105,7970I. doi:10.1073 / pnas.0803936105. PMC 2430346. PMID 18524949.
- ^ Halaszovich CR, Schreiber DN, Oliver D (leden 2009). „Ci-VSP je depolarizací aktivovaný fosfatidylinositol-4,5-bisfosfát a fosfatidylinositol-3,4,5-trisfosfát 5'-fosfatáza“. The Journal of Biological Chemistry. 284 (4): 2106–13. doi:10,1074 / jbc.M803543200. PMID 19047057.
- ^ Halaszovich, Christian R .; Schreiber, Daniela N .; Oliver, Dominik (2009-01-23). „Ci-VSP je depolarizací aktivovaný fosfatidylinositol-4,5-bisfosfát a fosfatidylinositol-3,4,5-trisfosfát 5'-fosfatáza“. The Journal of Biological Chemistry. 284 (4): 2106–2113. doi:10,1074 / jbc.M803543200. ISSN 0021-9258. PMID 19047057.
- ^ Kurokawa T, Takasuga S, Sakata S, Yamaguchi S, Horie S, Homma KJ, Sasaki T, Okamura Y (červen 2012). „3 'aktivita fosfatázy vůči fosfatidylinositol 3,4-bisfosfátu [PI (3,4) P2] fosfatázou se snímáním napětí (VSP)“. Sborník Národní akademie věd Spojených států amerických. 109 (25): 10089–94. doi:10.1073 / pnas.1203799109. PMC 3382541. PMID 22645351.
- ^ Matsuda M, Takeshita K, Kurokawa T, Sakata S, Suzuki M, Yamashita E, Okamura Y, Nakagawa A (červenec 2011). „Krystalová struktura cytoplazmatické fosfatázy a oblasti podobné tenzinu homologu (PTEN) v Ciona intestinalis fosfatázy detekující napětí poskytuje přehled o substrátové specificitě a redoxní regulaci aktivity fosfoinositid fosfatázy“. The Journal of Biological Chemistry. 286 (26): 23368–77. doi:10.1074 / jbc.M110.214361. PMC 3123101. PMID 21543329.
- ^ Li, Qufei; Wanderling, Sherry; Paduch, Marcin; Medovoy, David; Singharoy, Abhishek; McGreevy, Ryan; Villalba-Galea, Carlos A .; Hulse, Raymond E .; Roux, Benoît (01.03.2014). "Strukturální mechanismus napěťově závislého hradlování v izolované doméně snímání napětí". Přírodní strukturní a molekulární biologie. 21 (3): 244–252. doi:10.1038 / nsmb.2768. ISSN 1545-9985. PMC 4116111. PMID 24487958.
- ^ Liu L, Kohout SC, Xu Q, Müller S, Kimberlin CR, Isacoff EY, Minor DL (květen 2012). „Spínač glutamátu řídí funkci fosfatázy citlivou na napětí“. Přírodní strukturní a molekulární biologie. 19 (6): 633–41. doi:10.1038 / nsmb.2289. PMC 3529583. PMID 22562138.