Gating (elektrofyziologie) - Gating (electrophysiology)
v elektrofyziologie, termín vrata odkazuje na otvor (aktivace ) nebo zavření (deaktivací nebo deaktivací) iontové kanály.[1] Tato změna konformace je reakcí na změny transmembránového napětí.[2]
Když jsou iontové kanály v „uzavřeném“ (nevodivém) stavu, jsou nepropustný ionty a nevedou elektrický proud. Když jsou iontové kanály v otevřeném stavu, vedou elektrický proud tím, že jim umožňují procházet specifické typy iontů, a tedy přes plazmatická membrána z buňka. Gating je proces, při kterém iontový kanál přechází mezi otevřeným a uzavřeným stavem.[3]
Různé buněčné změny mohou vyvolat hradlování v závislosti na iontovém kanálu, včetně změn napětí na buněčné membráně (napěťově řízené iontové kanály ), chemikálie interagující s iontovým kanálem (ligandem řízené iontové kanály ), změny teploty,[4] protažení nebo deformace buněčné membrány, přidání a fosfát skupina na iontový kanál (fosforylace ) a interakce s jinými molekulami v buňce (např. G proteiny ).[5] Míra, při které k jakémukoli z těchto hradlových procesů dochází v reakci na tyto spouštěče, je známá jako kinetika brány. Některé léky a mnoho toxinů iontových kanálů působí jako „hradlové modifikátory“ napěťově řízených iontových kanálů změnou kinetiky hradlování.[6]
Napěťově řízené iontové kanály akční potenciál jsou často popisovány jako procesy se čtyřmi hradly: aktivace, deaktivace, inaktivace a reaktivace (nazývané také „zotavení z inaktivace“). Aktivace je proces otevírání aktivační brány, ke kterému dochází v reakci na napětí uvnitř buněčné membrány ( membránový potenciál ) stále pozitivnější s ohledem na vnějšek buňky (depolarizace ) a „deaktivace“ je opačný proces zavírání aktivační brány v reakci na to, že vnitřek membrány se stává negativnějším (repolarizace). „Inaktivace“ je uzavření inaktivační brány a probíhá v reakci na to, že napětí uvnitř membrány se stává pozitivnějším, ale pomaleji než aktivace. „Reaktivace“ je opakem deaktivace a jedná se o proces znovuotevření brány deaktivace.[7]
Tyto změny funkce závislé na napětí jsou kritické pro velký počet procesů v excitovatelných a neproduktivních buňkách.[2]
Aktivace
Napěťově řízené iontové kanály
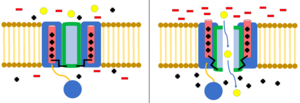
Napěťově řízené iontové kanály otevřít a zavřít v reakci na elektrický potenciál přes buněčnou membránu. Části domény kanálu fungují jako napěťové senzory. Jak se mění membránový potenciál, vede to ke změnám v elektrostatické síly, pohybující se těmito doménami snímajícími napětí. Tím se změní konformace ostatních prvků kanálu do otevřené nebo uzavřené polohy.[8] Když se pohybují ze zavřené polohy do otevřené polohy, nazývá se to „aktivace“. Napěťově řízené iontové kanály jsou základem mnoha elektrických chování buňky, včetně akčních potenciálů, klidových membránových potenciálů a synaptického přenosu.[9]
Napěťově řízené iontové kanály jsou často specifické pro ionty, včetně Na+, K.+, Ca2+a Cl−. Každý z těchto iontů hraje důležitou roli v elektrickém chování buňky.[9] Brány mají také jedinečné vlastnosti s důležitými fyziologickými důsledky. Například Na+ kanály se rychle otevírají a zavírají, zatímco K.+ brány se otevírají a zavírají mnohem pomaleji. Rozdíl v rychlosti mezi těmito kanály je základem fází depolarizace a repolarizace akčního potenciálu.[10]
Na+ Kanály
Napěťově řízený sodík (Na+) kanály jsou významné, pokud jde o šíření akčních potenciálů v neuronech a jiných excitabilních buňkách, většinou se používají k šíření akčního potenciálu v axonech, svalových vláknech a neurálním somatodendritickém oddělení.[11] Sodík (Na+) kanály jsou některé z hlavních iontových kanálů odpovědných za akční potenciály.[9] Jsou složité a jsou vyrobeny z větších podjednotek α, které jsou poté spárovány se dvěma menšími podjednotkami β.[11] Obsahují transmembránové segmenty známé jako S1-6. Nabité segmenty S4 jsou snímače napětí kanálů. Když jsou vystaveny určitému rozdílu minimálního potenciálu, segmenty S4 se pohybují přes membránu.[12] To způsobí pohyb linkeru S4-S5, který způsobí zkroucení linkeru S5-S6 a otevření kanálu.[13]
K.+ Kanály
Draslík (K.+) Kanály hrají velkou roli při určování klidového membránového potenciálu.[9] Když se depolarizuje buněčná membrána, intracelulární část kanálu se pozitivně nabije, což způsobí, že otevřená konfigurace kanálu se stane stabilnějším stavem než uzavřená konfigurace. Existuje několik modelů aktivace draslíkových kanálů:
- The model posuvné šroubovice předpokládá, že se draslíkový kanál otevírá v důsledku šroubovacího pohybu pomocí šroubovice S4.
- The pádlo model předpokládá, že šroubovice S3 a S4 kanálu tvoří „lopatky“, které se pohybují přes depolarizovanou membránu a odtahují šroubovice S5 od otvoru kanálu.
- The dopravní model předpokládá, že zaostřené elektrické pole způsobí, že nabité částice se pohybují po kanálu pouze s malým pohybem šroubovice S4.
- Model koordinovaný pohyb šroubovic předpokládá, že helixy S4 a S5 se oba otáčejí a linker S4-S5 způsobí pohyb helixu S6 a otevření kanálu.
- The model konsensu je průměr výše uvedených modelů, který je pomáhá sladit s experimentálními daty.[14]
Ca.2+ Kanály
Vápník (Ca2+) kanály regulují uvolňování neurotransmiterů v synapsích, řídí tvar akčních potenciálů vytvářených sodíkovými kanály a v některých neuronech generují akční potenciály.[9] Vápníkové kanály se skládají ze šesti transmembránových šroubovic. S4 funguje jako snímač napětí otáčením, když je vystaven určitým membránovým potenciálům, čímž otevírá kanál.[15]

Neurotransmitery jsou zpočátku ukládány a syntetizovány ve vezikulích na synapse neuronu. Když v buňce dojde k akčnímu potenciálu, elektrický signál dosáhne presynaptického terminálu a depolarizace způsobí otevření vápníkových kanálů, čímž se uvolní vápník, aby se dostal dolů po svém elektrochemickém gradientu. Tento příliv vápníku následně způsobí fúzi vezikul neurotransmiteru s presynaptickou membránou.[16] Ionty vápníku iniciují interakci povinných kofaktorových proteinů s proteiny SNARE za vzniku komplexu SNARE.[16] Tyto komplexy SNARE zprostředkovávají fúzi vezikul tažením membrán k sobě a únikem neurotransmiterů do synaptické štěrbiny. Molekuly neurotransmiteru pak mohou signalizovat další buňku prostřednictvím receptorů na postsynaptické membráně. Tyto receptory mohou fungovat jako iontové kanály nebo GPCR (receptory spojené s G-proteinem).[17] Neurotransmiter může obecně způsobit excitační nebo inhibiční reakci v závislosti na tom, co se na receptoru vyskytuje.
Cl− Kanály
Chloridové kanály jsou další skupinou napěťově řízených iontových kanálů, které jsou méně známé. Jsou zapojeni do procesů, jako je kosterní a srdeční hladký sval, regulace objemu buněk, buněčný cyklus a apoptóza.[18] Jedna hlavní rodina chloridových proteinů se nazývá CLC proteiny - běžné kanály a transportéry pro základní fyziologické procesy u savců. Kanály CLC fungují jako kanály s pomalou bránou; vodíkové ionty jsou vyměňovány za příliv chloridových iontů, což umožňuje aniontům cestovat přes jejich elektrochemický gradient.[19] Napěťově závislý chloridový kanál C1C-1 je homologní dimer, který spadá do této rodiny, a je vidět převážně ve vláknech kosterního svalstva.[20] U tohoto kanálu je správná depolarizace a repolarizace pomocí chloridových iontů nezbytná pro šíření akčního potenciálu.[18]
Ligandové iontové kanály
Ligandové iontové kanály se nacházejí na postsynaptických neuronech. Ve výchozím nastavení předpokládají svou uzavřenou konformaci. Když presynaptický neuron uvolní neurotransmitery na konci akčního potenciálu, váží se na iontové kanály řízené ligandem. To způsobí, že kanály předpokládají svou otevřenou konformaci, což umožňuje iontům protékat kanály dolů po jejich koncentračním gradientu. Ligandové iontové kanály jsou odpovědné za rychlý synaptický přenos v nervovém systému a na neuromuskulárním spojení.[21] Každý iontový kanál řízený ligandem má širokou škálu receptorů s odlišnými biofyzikálními vlastnostmi a vzorci exprese v nervovém systému.[22]
Inaktivace
Inaktivace je, když je tok iontů blokován jiným mechanismem než uzavřením kanálu.[8] Kanál v otevřeném stavu může přestat propouštět ionty nebo může být kanál v uzavřeném stavu preventivně inaktivován, aby se zabránilo toku iontů.[23] K deaktivaci obvykle dochází, když se depolarizuje buněčná membrána, a končí, když se obnoví klidový potenciál.[8]
U sodíkových kanálů se zdá, že inaktivace je výsledkem působení šroubovic III-VI, přičemž III a IV fungují jako jakési zavěšené víčko, které blokuje kanál. Přesný mechanismus je špatně pochopen, ale zdá se, že se spoléhá na částice, která má vysokou afinitu k exponovanému vnitřku otevřeného kanálu.[24] Rychlá deaktivace umožňuje kanálu zastavit tok sodíku velmi krátce po převzetí jeho otevřené konformace.[25]
Inaktivace kuliček a řetězů
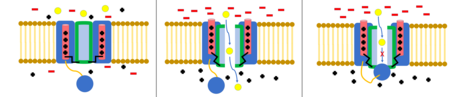
The kuličkový a řetězový model, známý také jako inaktivace typu N nebo inaktivace se zavěšeným víkem, je hradlovací mechanismus pro některé napěťově řízené iontové kanály. Napěťově řízené iontové kanály se skládají ze 4[pochybný ] α podjednotky, z nichž jedna nebo více bude mít kulovou doménu umístěnou na své cytoplazmatický N-konec.[26] Kuličková doména je elektrostaticky přitahována k doméně vnitřního kanálu. Když je aktivován iontový kanál, je obnažena doména vnitřního kanálu a během milisekund se řetěz sklopí a koule vstoupí do kanálu, čímž dojde k průniku iontů.[27] Kanál se vrací do uzavřeného stavu, blokuje doménu kanálu a koule opouští póry.[28]
Deaktivace

Deaktivace je návrat iontového kanálu do jeho uzavřené konformace. U napěťově řízených kanálů k tomu dochází, když se napěťový rozdíl, který původně způsobil otevření kanálu, vrátí na svou klidovou hodnotu.[29]
V napěťově řízených sodíkových kanálech je deaktivace nezbytná k zotavení z inaktivace.[24]
V napěťově řízených draslíkových kanálech je pravý opak a deaktivace zpomaluje zotavení kanálu z aktivace.[30] Ve výchozím nastavení se předpokládá uzavřená konformace, která zahrnuje částečné narovnání šroubovice VI linkerem IV-V. Mechanismy, které způsobují otevírání a zavírání, plně nerozumí. Uzavřená konformace se jeví jako konformace s vyšší energií než otevřená konformace, což může také pomoci vysvětlit, jak se aktivuje iontový kanál.[31]
Kvantifikace
Vratový náboj lze vypočítat řešením Poissonova rovnice. Nedávné studie navrhly metodu simulace molekulární dynamiky k určení hradlového náboje měřením elektrických kondenzátorových vlastností proteinů zabudovaných do membrány.[2] Aktivitu iontových kanálů umístěných v plazmové membráně lze měřit jednoduchým připojením skleněné kapilární elektrody kontinuálně k membráně.[32] Další iontové kanály umístěné v membránách mitochondrií, lysozomů a Golgiho aparátu lze měřit naléhavou technikou, která zahrnuje použití umělé dvouvrstvé lipidové membrány připojené k 16 elektrodovému zařízení, které měří elektrickou aktivitu.[32]
Viz také
Reference
- ^ Alberts, Bruce; Bray, Dennis; Lewis, Julian; Raff, Martin; Roberts, Keith; Watson, James D. (1994). Molekulární biologie buňky. New York: Garland. str.523–547. ISBN 978-0-8153-1620-6.
- ^ A b C Machtens, Jan-Philipp; Briones, Rodolfo; Alleva, Claudia; de Groot, Bert L .; Fahlke, Christoph (11.04.2017). „Výpočty hradlového náboje výpočtovými simulacemi elektrofyziologie“. Biofyzikální deník. 112 (7): 1396–1405. Bibcode:2017BpJ ... 112.1396M. doi:10.1016 / j.bpj.2017.02.016. ISSN 0006-3495. PMC 5389965. PMID 28402882.
- ^ Goychuk, Igor; Hänggi, Peter (19. 3. 2002). „Vrata iontového kanálu: Analýza času prvního průchodu typu Kramers“. Sborník Národní akademie věd Spojených států amerických. 99 (6): 3552–3556. arXiv:fyzika / 0111187. Bibcode:2002PNAS ... 99.3552G. doi:10.1073 / pnas.052015699. ISSN 0027-8424. PMC 122561. PMID 11891285.
- ^ Cesare P, Moriondo A, Vellani V, McNaughton PA (červenec 1999). „Ion kanály uzavřené teplem“. Proc. Natl. Acad. Sci. USA. 96 (14): 7658–63. Bibcode:1999PNAS ... 96.7658C. doi:10.1073 / pnas.96.14.7658. PMC 33597. PMID 10393876.
- ^ Hille, Bertil (2001). Iontové kanály dráždivých membrán. Sunderland, Massachusetts: Sinauer. ISBN 978-0-87893-321-1.
- ^ Waszkielewicz, A.M .; Gunia, A; Szkaradek, N; Słoczyńska, K; Krupińska, S; Marona, H (duben 2013). „Ionové kanály jako léky zaměřené na poruchy centrálního nervového systému“. Současná léčivá chemie. 20 (10): 1241–1285. doi:10.2174/0929867311320100005. ISSN 0929-8673. PMC 3706965. PMID 23409712.
- ^ Ahern, Christopher A .; Payandeh, Jian; Bosmans, Frank; Chanda, Baron (leden 2016). „Stopařův průvodce galaxií sodíkovým kanálem s napětím“. The Journal of General Physiology. 147 (1): 1–24. doi:10.1085 / jgp.201511492. ISSN 0022-1295. PMC 4692491. PMID 26712848.
- ^ A b C Bähring, Robert; Covarrubias, Manuel (01.02.2011). „Mechanismy inaktivace v uzavřeném stavu v napěťově řízených iontových kanálech“. The Journal of Physiology. 589 (Pt 3): 461–479. doi:10.1113 / jphysiol.2010.191965. ISSN 0022-3751. PMC 3055536. PMID 21098008.
- ^ A b C d E Purves, Dale; Augustine, George J .; Fitzpatrick, David; Katz, Lawrence C .; LaMantia, Anthony-Samuel; McNamara, James O .; Williams, S. Mark (2001). „Napěťově řízené iontové kanály“. Neurovědy. 2. vydání.
- ^ Grider, Michael H .; Glaubensklee, Carolyn S. (2019), "Fyziologie, akční potenciál", StatPearls, StatPearls Publishing, PMID 30844170, vyvoláno 2019-10-29
- ^ A b Mantegazza, Massimo; Catterall, William A. (2012), Noebels, Jeffrey L .; Avoli, Massimo; Rogawski, Michael A .; Olsen, Richard W. (eds.), „Napěťově řízené kanály Na +: struktura, funkce a patofyziologie“, Jasperovy základní mechanismy epilepsií (4th ed.), National Center for Biotechnology Information (US), PMID 22787615, vyvoláno 2019-11-03
- ^ Sula, Altin; Booker, Jennifer; Ng, Leo C. T .; Naylor, Claire E .; DeCaen, Paul G .; Wallace, B. A. (2017-02-16). "Kompletní struktura aktivovaného otevřeného sodíkového kanálu". Příroda komunikace. 8 (1): 14205. Bibcode:2017NatCo ... 814205S. doi:10.1038 / ncomms14205. ISSN 2041-1723. PMC 5316852. PMID 28205548.
- ^ Catterall, William A. (2013-11-14). "Struktura a funkce napěťově řízených sodíkových kanálů při atomovém rozlišení". Experimentální fyziologie. 99 (1): 35–51. doi:10.1113 / expphysiol.2013.071969. ISSN 0958-0670. PMC 3885250. PMID 24097157.
- ^ Grizel, A. V .; Glukhov, G. S .; Sokolova, O. S. (říjen – prosinec 2014). „Mechanismy aktivace napěťově řízených draslíkových kanálů“. Acta Naturae. 6 (4): 10–26. doi:10.32607/20758251-2014-6-4-10-26. PMC 4273088. PMID 25558391.
- ^ Catterall, William A. (srpen 2011). „Napěťově řízené vápníkové kanály“. Perspektivy Cold Spring Harbor v biologii. 3 (8): a003947. doi:10.1101 / cshperspect.a003947. ISSN 1943-0264. PMC 3140680. PMID 21746798.
- ^ A b Südhof, Thomas C. (leden 2012). "Kontrola vápníku při uvolňování neurotransmiteru". Perspektivy Cold Spring Harbor v biologii. 4 (1): a011353. doi:10.1101 / cshperspect.a011353. ISSN 1943-0264. PMC 3249630. PMID 22068972.
- ^ Yoon, Tae-Young; Lu, Xiaobing; Diao, Jiajie; Lee, So-Min; Ha, Taekjip; Shin, Yeon-Kyun (červen 2008). „Komplexin a Ca 2+ stimulují fúzi membrány zprostředkovanou SNARE“. Přírodní strukturní a molekulární biologie. 15 (7): 707–713. doi:10.1038 / nsmb.1446. ISSN 1545-9985. PMC 2493294. PMID 18552825.
- ^ A b „Chloridové kanály“. British Journal of Pharmacology. 158 (Suppl 1): S130 – S134. Listopad 2009. doi:10.1111 / j.1476-5381.2009.00503_6.x. ISSN 0007-1188. PMC 2884561.
- ^ Accardi, Alessio; Picollo, Alessandra (srpen 2010). „CLC kanály a transportéry: proteiny s hraničními osobnostmi“. Biochimica et Biophysica Acta (BBA) - biomembrány. 1798 (8): 1457–1464. doi:10.1016 / j.bbamem.2010.02.022. ISSN 0006-3002. PMC 2885512. PMID 20188062.
- ^ Imbrici, Paola; Altamura, Concetta; Pessia, Mauro; Mantegazza, Renato; Desaphy, Jean-François; Camerino, Diana Conté (2015-04-27). „Chloridové kanály ClC-1: nejmodernější výzkum a budoucí výzvy“. Hranice v buněčné neurovědě. 9: 156. doi:10.3389 / fncel.2015.00156. ISSN 1662-5102. PMC 4410605. PMID 25964741.
- ^ Alexander, SPH; Mathie, A; Peters, JA (listopad 2011). „Ionové kanály s ligandovými bránami“. British Journal of Pharmacology. 164 (Suppl 1): S115 – S135. doi:10.1111 / j.1476-5381.2011.01649_4.x. ISSN 0007-1188. PMC 3315629.
- ^ Alexander, SPH; Mathie, A; Peters, JA (2011). „Iontové kanály s ligandovými bránami“. Br J Pharmacol. 164 (Suppl 1): S115 – S135. doi:10.1111 / j.1476-5381.2011.01649_4.x. PMC 3315629.
- ^ Armstrong, Clay M. (2006-11-21). „Inaktivace kanálu Na z otevřeného a uzavřeného stavu“. Sborník Národní akademie věd. 103 (47): 17991–17996. Bibcode:2006PNAS..10317991A. doi:10.1073 / pnas.0607603103. ISSN 0027-8424. PMC 1693860. PMID 17101981.
- ^ A b Kuo, Chung-Chin; Bean, Bruce P. (01.04.1994). "Kanály Na + se musí deaktivovat, aby se zotavily z deaktivace". Neuron. 12 (4): 819–829. doi:10.1016/0896-6273(94)90335-2. ISSN 0896-6273. PMID 8161454. S2CID 41285799.
- ^ Yu, Frank H; Catterall, William A (2003). "Přehled rodiny sodíkových kanálů s napětím". Genome Biology. 4 (3): 207. doi:10.1186 / gb-2003-4-3-207. ISSN 1465-6906. PMC 153452. PMID 12620097.
- ^ „Modulace inaktivace kanálu N + typu sulfatací přes sirovodík a polysulfidy“. rdcu.be. Citováno 2018-11-22.
- ^ Holmgren, M .; Jurman, M.E .; Yellen, G. (září 1996). „Inaktivace typu N a oblast S4-S5 kanálu Shaker K +“. The Journal of General Physiology. 108 (3): 195–206. doi:10.1085 / jgp.108.3.195. ISSN 0022-1295. PMC 2229322. PMID 8882863.
- ^ Bénitah, J. P .; Chen, Z .; Balser, J. R .; Tomaselli, G. F .; Marbán, E. (01.03.1999). „Molekulární dynamika pórů sodíkových kanálů se liší podle brány: interakce mezi pohyby P-segmentu a inaktivací“. The Journal of Neuroscience. 19 (5): 1577–1585. doi:10.1523 / JNEUROSCI.19-05-01577.1999. ISSN 0270-6474. PMC 6782169. PMID 10024345.
- ^ Bähring, Robert; Covarrubias, Manuel (28.01.2011). "Mechanismy uzavřené deaktivace v napěťově řízených iontových kanálech". The Journal of Physiology. 589 (3): 461–479. doi:10.1113 / jphysiol.2010.191965. ISSN 0022-3751. PMC 3055536. PMID 21098008.
- ^ Kuo, Chung-Chin (1997-05-15). „Deaktivace zpomaluje zotavení z deaktivace v kanálech Shaker K +“. The Journal of Neuroscience. 17 (10): 3436–3444. doi:10.1523 / JNEUROSCI.17-10-03436.1997. ISSN 0270-6474. PMC 6573675. PMID 9133369.
- ^ Fowler, Philip W .; Sansom, Mark S. P. (2013-05-21). "Pór napěťově řízených draslíkových iontových kanálů je při uzavření napjatý". Příroda komunikace. 4 (1): 1872. Bibcode:2013NatCo ... 4.1872F. doi:10.1038 / ncomms2858. ISSN 2041-1723. PMC 3674235. PMID 23695666.
- ^ A b Kamiya, Koki; Osaki, Toshihisa; Nakao, Kenji; Kawano, Ryuji; Fujii, Satoshi; Misawa, Nobuo; Hayakawa, Masatoshi; Takeuchi, Shoji (2018-11-30). „Elektrofyziologické měření iontových kanálů na plazmatických / organelárních membránách pomocí lipidového dvouvrstvého systému na čipu“. Vědecké zprávy. 8 (1): 17498. Bibcode:2018NatSR ... 817498K. doi:10.1038 / s41598-018-35316-4. ISSN 2045-2322. PMC 6269590. PMID 30504856.
