Viridin - Viridin
 | |
| Jména | |
|---|---|
| Název IUPAC (LS, 2S, llbR) -l-hydroxy-2-methoxy-llb-methyl-l, 7,8,11b-tetrahydrocyklopenta [7,8] fenanthro [10,1-bc] furan-3,6,9 ( 2H) -trion | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.019.989 |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C20H16Ó6 | |
| Molární hmotnost | 352,337 g mol−1 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Viridin je antimykotikum metabolit z Gliocladium virens to bylo poprvé hlášeno v roce 1945.[1] Patří do třídy molekul známých jako furanosteroidy, má charakteristický vysoce napjatý elektrofilní furanový kruh fúzovaný mezi C-4 a C-6 steroid rámec. Členové této rodiny, včetně wortmannin je známo, že jsou silnými ireverzibilními kovalentními inhibitory fosfoinositid 3-kinázy (PI3Ks).[2]
Biosyntéza
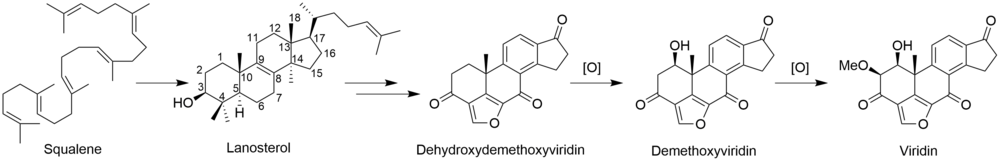
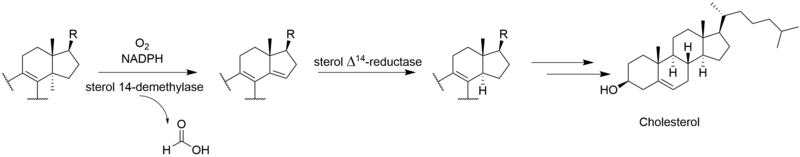
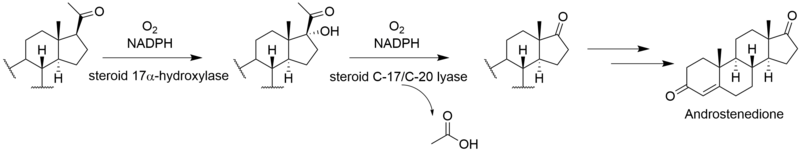
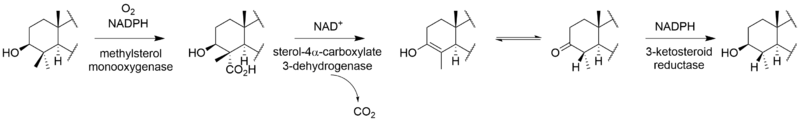
Kompletní biosyntéza viridinu není známo. Prostřednictvím [2-14Studie značení kyselinou mevalonovou C] ukázaly, že viridin je biosyntetizován z a triterpenoid cesta, která začíná od skvalen, spíše než a diterpenoid cesta.[3] Založení společnosti lanosterol do viridinu.[4] Ačkoli mechanismy a pořadí zbývajících kroků od lanosterolu k viridinu nejsou jisté, patří mezi ně tvorba furanového kruhu, ztráta C-13 a C-14 methylových skupin, aromatizace C-kruhu, odstranění boční řetězce a oxidace A-kruhu. Některé z těchto kroků mohou být analogické s cestami jiných steroidů. Ztráta atomu vodíku z C-15 během odstraňování methylové skupiny C-14 naznačuje cestu podobnou dráze jiných biosyntéz steroidů.[5] Analogicky k cholesterol cestou se methylová skupina C-14 ztrácí jako kyselina mravenčí působením sterol 14-demethylázy.[6] Ačkoli methylová skupina C-13 není odstraněna v cestě aldosteron, je možné, že viridin podléhá analogické oxidaci na C-18 následované ztrátou kyseliny mravenčí nebo dekarboxylací za účelem odstranění C-13 methylu. Ukázalo se, že odstranění postranního řetězce sleduje savčí dráhu.[7] Pravděpodobně sleduje cestu androstendion a oxidativně odstraňuje postranní řetězec jako kyselinu octovou, což vede ke ketonu na D-kruhu.[6] „Extra“ uhlík ve furanovém kruhu na C-4 pochází z 3'-polohy kyseliny mevalonové a představuje C-4β-methylovou skupinu lanosterolu.[5] Oxidace a dekarboxylace C-4a-methylové skupiny je v souladu s normální cestou savčích steroidů; místo opakování těchto kroků k odstranění druhé methylové skupiny je však druhá oxidovaná methylová skupina pravděpodobně zachycena za vzniku furanového kruhu neznámým mechanismem. Studie ukazují, že aromatizace C-kruhu probíhá bez přeskupení kostry.[5]
V biosyntéze viridiolu od Gliocladium deliquescens, 3P-OH redukovaná forma viridinu, bylo hlášeno začlenění skvalenu, lanosterolu, dehydroxydemethoxyviridinu a demethoxyviridinu.[8][9] To naznačuje, že vicinální okysličování na C-1 a C-2 jsou nezávislé kroky zahrnující hydroxylaci.
Reference
- ^ BRIAN, P. W .; MCGOWAN, J. G. (4. srpna 1945). „Viridin: vysoce fungistatická látka produkovaná Trichoderma viride“. Příroda. 156 (3953): 144–145. doi:10.1038 / 156144a0.
- ^ Yano, H; Nakanishi, S; Kimura, K; Hanai, N; Saitoh, Y; Fukui, Y; Nonomura, Y; Matsuda, Y (5. prosince 1993). „Inhibice sekrece histaminu wortmanninem blokádou fosfatidylinositol 3-kinázy v buňkách RBL-2H3“. The Journal of Biological Chemistry. 268 (34): 25846–56. PMID 7503989.
- ^ Blight, Margaret M .; Coppen, J. J. W .; Grove, John Frederick. „Biogeneze steroidního antifungálního metabolitu viridinu z kyseliny mevalonové“. Chemical Communications (Londýn) (18): 1117. doi:10.1039 / C19680001117.
- ^ Golder, Walter S .; Watson, Thomas R. "Deriváty lanosterolu jako prekurzory v biosyntéze viridinu. Část 1". Journal of the Chemical Society, Perkin Transactions 1: 422. doi:10.1039 / P19800000422.
- ^ A b C Hanson, James R .; O'Leary, Margaret A .; Wadsworth, Harry J. "Studie v biosyntéze terpenoidů. Část 28. Acetátové a mevalonátové vzorce označování steroidů, demethoxyviridinu". Journal of the Chemical Society, Perkin Transactions 1: 867. doi:10.1039 / P19830000867.
- ^ A b Dewick, Paul M. (2009). Léčivé přírodní produkty: biosyntetický přístup (3. vyd.). Chichester: John Wiley & Sons. ISBN 978-0-470-74167-2.
- ^ Hanson, James R .; O'Leary, Margaret A .; Wadsworth, Harry J. „Plísňové štěpení sterolového postranního řetězce“. Journal of the Chemical Society, Chemical Communications (18): 853. doi:10.1039 / C39800000853.
- ^ Hanson, James R .; O'leary, Margaret A .; Wadsworth, Harry J .; Boon, lene yeoh. „Biosyntéza steroidu, viridiolu, Gliocladium deliquescens“. Fytochemie. 27 (2): 387–389. doi:10.1016/0031-9422(88)83104-2.
- ^ Jones, Richard (1987). "Konverze viridinu na viridiol houbami produkujícími viridin". Canadian Journal of Microbiology. 33 (11): 963–966. doi:10,1139 / m87-169.
