tert-Butylchlorid - tert-Butyl chloride - Wikipedia
| |||
 | |||
| Jména | |||
|---|---|---|---|
| Název IUPAC 2-chlor-2-methylpropan | |||
| Ostatní jména 1,1-dimethylethylchlorid L-chlor-l, l-dimethylethan chlortrimethylmethan trimethylchlormethan t-butylchlorid | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.007.334 | ||
| Číslo ES |
| ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 1127 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H9Cl | |||
| Molární hmotnost | 92,57 g / mol | ||
| Vzhled | Bezbarvá kapalina | ||
| Hustota | 0,851 g / ml | ||
| Bod tání | −26 ° C (−15 ° F; 247 K) | ||
| Bod varu | 51 ° C (124 ° F; 324 K) | ||
| Málo rozpustný ve vodě, mísitelný s alkoholem a etherem | |||
| Tlak páry | 34,9 kPa (20 ° C) | ||
| Nebezpečí | |||
| Piktogramy GHS |  | ||
| Signální slovo GHS | Nebezpečí | ||
| H225 | |||
| P210, P233, P240, P241, P242, P243, P280, P303 + 361 + 353, P370 + 378, P403 + 235, P501 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | -9 ° C (16 ° F; 264 K) (otevřený kelímek) −23 ° C (uzavřený kelímek) | ||
| 540 ° C (1004 ° F; 813 K) | |||
| Související sloučeniny | |||
Příbuzný alkylhalogenidy | terc-butylbromid | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
tert-Butylchlorid je organochlorid se vzorcem (CH3)3CCl. Je to bezbarvá, hořlavá kapalina. Je mírně rozpustný v voda, s tendencí podstoupit hydrolýza na odpovídající tert-butylalkohol. Vyrábí se průmyslově jako předchůdce jiných organických sloučenin.[1]
Syntéza
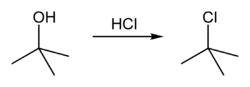
tert-Butylchlorid se vyrábí reakcí tert-butylalkohol s chlorovodík.[1] V laboratoři, koncentrovaný kyselina chlorovodíková se používá. Přeměna zahrnuje S.N1 reakce, jak je uvedeno níže.[2]
 | 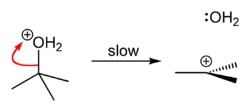 |  |
Celková reakce tedy je:
Protože tert-butanol je terciární alkohol, což je relativní stabilita tert-butylkarbokace v kroku 2 umožňuje SN1 mechanismus, který je třeba dodržovat, zatímco primární alkohol by následoval SN2 mechanismus.
Reakce
Když tert-butylchlorid je rozpuštěn ve vodě, prochází a hydrolýza na tert-butylalkohol. Po rozpuštění v alkoholech se vyrobí odpovídající t-butylethery.
Použití
tert-Butylchlorid se používá k přípravě antioxidantu tert-butylfenol a vůně neohexylchloridu.[1]
Reference
- ^ A b C M. Rossberg a kol. "Chlorované uhlovodíky" v Ullmann's Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a06_233.pub2
- ^ James F. Norris a Alanson W. Olmsted "tert-Butylchlorid "Org. Synth. 1928, svazek 8, str. 50. doi:10.15227 / orgsyn.008.0050