Risdiplam - Risdiplam
 | |
| Klinické údaje | |
|---|---|
| Obchodní názvy | Evrysdi |
| Ostatní jména | RG7916; RO7034067 |
| AHFS /Drugs.com | Monografie |
| Licenční údaje | |
| Těhotenství kategorie |
|
| Trasy z správa | Pusou |
| ATC kód |
|
| Právní status | |
| Právní status | |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| Chemické a fyzikální údaje | |
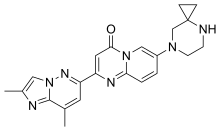
| Vzorec | C22H23N7Ó |
| Molární hmotnost | 401.474 g · mol−1 |
| 3D model (JSmol ) | |
| |
| |
Risdiplam, prodávané pod značkou Evrysdi, je lék používaný k léčbě spinální svalová atrofie (SMA)[2][3] a první orální léky schválen k léčbě této nemoci.[2][3]
Risdiplam je přežití motorického neuronu 2 - směrováno Modifikátor sestřihu RNA.[2][1][4]
Mezi nejčastější nežádoucí účinky patří horečka, průjem, vyrážka, vředy v ústech, bolesti kloubů (artralgie) a infekce močových cest.[2][1] Mezi další vedlejší účinky pro populaci začínající v dětství patří infekce horních cest dýchacích, zápal plic, zácpa a zvracení.[2][1]
Byl schválen USA Úřad pro kontrolu potravin a léčiv (FDA) v srpnu 2020 k léčbě dospělých a dětí ve věku dvou měsíců nebo starších.[2][5] Vyvinuto ve spolupráci s PTC Therapeutics a Nadace SMA,[3][5] v USA je prodáván společností Genentech,[2] dceřiná společnost společnosti Roche.[5]
Lékařské použití
Ve Spojených státech je risdiplam indikován k léčbě lidí ve věku dvou měsíců a starších se spinální svalovou atrofií.[2][1]
Nepříznivé účinky
Mezi nejčastější nežádoucí účinky patří horečka, průjem, vyrážka, vředy v ústech, bolesti kloubů (artralgie) a infekce močových cest.[2][1] Mezi další vedlejší účinky pro populaci začínající v dětství patří infekce horních cest dýchacích, zápal plic, zácpa a zvracení.[2][1]
Risdiplam by neměl být užíván společně s léky, které jsou vytlačování více drog a toxinů (MATE) substráty, protože risdiplam může zvyšovat plazmatické koncentrace těchto léků.[2][1]
Farmakologie
Mechanismus účinku
Risdiplam řeší základní příčinu SMA: snížené množství motorický neuron přežití (SMN) protein. Protein je kódován SMN1 a SMN2 geny. SMA je způsobena mutacemi v SMN1 ten kód pro neaktivní formy proteinu. Činnost SMN2 gen, který produkuje mnohem menší množství SMN, má tendenci určovat závažnost onemocnění.[3][6]
Sloučenina je a pyridazin derivát, který upravuje sestřih z SMN2 messenger RNA,[7][4] což má za následek až dvojnásobné zvýšení koncentrace funkčního proteinu SMN in vivo.[8]
Nusinersen, první lék schválený k léčbě SMA, funguje podobným způsobem.[9]
Účinnost
Bezpečnost a účinnost risdiplamu u SMA s infantilním a pozdějším nástupem byla hodnocena ve dvou probíhajících klinické testy.[3][10][11]
Ve studii SMA s infantilním nástupem, otevřené studii se 41 účastníky, byla účinnost stanovena na základě schopnosti sedět bez podpory po dobu nejméně pěti sekund. Po 12 měsících léčby bylo 29% účastníků schopno samostatně sedět déle než pět sekund. Po 23 nebo více měsících léčby bylo 81% účastníků naživu bez trvalé ventilace. Ačkoli studie neprováděla přímé srovnání s dětmi, které dostávaly a placebo (neaktivní léčba), tyto výsledky se příznivě srovnávají s typickým průběhem neléčeného onemocnění.[10][2]
Studie pozdějšího nástupu SMA byla randomizovaná kontrolovaná studie, do které bylo zařazeno 180 účastníků ve věku od 2 do 25 let s méně závažnými formami onemocnění. Účastníci léčení risdiplamem po dobu 12 měsíců vykazovali zlepšení motorických funkcí ve srovnání s účastníky, kterým bylo podáváno placebo.[11][2][3]
Od srpna 2020 probíhají dvě další klinické studie.[3][5]
Společnost a kultura
Právní status
Spojené státy Úřad pro kontrolu potravin a léčiv (FDA) udělil společnosti Genentech souhlas s uvedením na trh 7. srpna 2020. FDA dříve vyhověla žádosti o risdiplam rychlá dráha, prioritní kontrola, a lék na vzácná onemocnění označení.[2][3][5] Genentech byl také oceněn a poukaz na kontrolu priority vzácných pediatrických onemocnění.[2]
The Evropská agentura pro léčivé přípravky (EMA) udělila risdiplam v roce 2018 označení prioritního léčiva[5][12][13] a lék na vzácná onemocnění označení v roce 2019.[14][5]
Od srpna 2020[Aktualizace], Požádala Roche registrace v Brazílii, Chile, Číně, Evropské unii, Indonésii, Rusku, Jižní Koreji a na Tchaj-wanu.[5][15]
Jména
Risdiplam je Mezinárodní nechráněný název (HOSPODA).[16]
Soucitné použití
Od konce roku 2019 společnost Roche nabízí drogu globálně zdarma pro způsobilé lidi prostřednictvím program rozšířeného přístupu.[17]
Reference
- ^ A b C d E F G h „Prášek Evrysdi-risdiplam, pro roztok“. DailyMed. 18. srpna 2020. Citováno 24. září 2020.
- ^ A b C d E F G h i j k l m n Ó p „FDA schvaluje orální léčbu spinální svalové atrofie“. NÁS. Úřad pro kontrolu potravin a léčiv (FDA) (Tisková zpráva). 7. srpna 2020. Citováno 7. srpna 2020.
 Tento článek včlení text z tohoto zdroje, který je v veřejná doména.
Tento článek včlení text z tohoto zdroje, který je v veřejná doména. - ^ A b C d E F G h „Evrysdi (Risdiplam)“. smanewstoday.com. 7. srpna 2020. Citováno 8. srpna 2020.
- ^ A b Zhao X, Feng Z, Ling KK, Mollin A, Sheedy J, Yeh S a kol. (Květen 2016). „Farmakokinetika, farmakodynamika a účinnost modifikátoru sestřihu SMN2 s malou molekulou v myších modelech spinální svalové atrofie“. Lidská molekulární genetika. 25 (10): 1885–99. doi:10,1093 / hmg / ddw062. PMC 5062580. PMID 26931466.
- ^ A b C d E F G h „FDA schvaluje společnost Genentech's Evrysdi (risdiplam) pro léčbu spinální svalové atrofie (SMA) u dospělých a dětí starších 2 měsíců“. Genentech (Tisková zpráva). 7. srpna 2020. Citováno 7. srpna 2020.
- ^ Ramdas, Sithara; Servais, Laurent (24. ledna 2020). "Nová léčba spinální svalové atrofie: přehled aktuálně dostupných údajů". Znalecký posudek na farmakoterapii. Informa UK Limited. 21 (3): 307–315. doi:10.1080/14656566.2019.1704732. ISSN 1465-6566. PMID 31973611. S2CID 210880199.
- ^ Maria Joao Almeida (08.09.2016). „RG7916“. Služby BioNews. Citováno 2017-10-08.
- ^ Ratni, Hasane; Ebeling, Martin; Baird, John; Bendels, Stefanie; Bylund, Johan; Chen, Karen S .; Denk, Nora; Feng, Zhihua; Zelená, Luke; Guerard, Melanie; Jablonski, Philippe; Jacobsen, Bjoern; Khwaja, Omar; Kletzl, Heidemarie; Ko, Chien-Ping; Kustermann, Stefan; Marquet, Anne; Metzger, Friedrich; Mueller, Barbara; Naryshkin, Nikolai A .; Paushkin, Sergey V .; Pinard, Emmanuel; Poirier, Agnès; Reutlinger, Michael; Weetall, Marla; Zeller, Andreas; Zhao, Xin; Mueller, Lutz (25. července 2018). „Objev Risdiplam, selektivního přežití modifikátoru genového sestřihu motorického neuronu-2 (SMN2) pro léčbu spinální svalové atrofie (SMA)“. Journal of Medicinal Chemistry. Americká chemická společnost (ACS). 61 (15): 6501–6517. doi:10.1021 / acs.jmedchem.8b00741. ISSN 0022-2623. PMID 30044619.
- ^ Zanetta C, Nizzardo M, Simone C, Monguzzi E, Bresolin N, Comi GP a kol. (Leden 2014). „Molekulární terapeutické strategie pro spinální svalové atrofie: současné a budoucí klinické studie“. Klinická terapeutika. 36 (1): 128–40. doi:10.1016 / j.clinthera.2013.11.006. PMID 24360800.
- ^ A b Baranello G, Servais L, den J, Deconinck N, Mercuri E, Klein A a kol. (Říjen 2019). „P.353FIREFISH Část 1: 16měsíční bezpečnostní a průzkumné výsledky léčby risdiplamem (RG7916) u kojenců se spinální svalovou atrofií typu 1“. Neuromuskulární poruchy. 29: S184. doi:10.1016 / j.nmd.2019.06.515. ISSN 0960-8966.
- ^ A b Mercuri E, Baranello G, Kirschner J, Servais L, Goemans N, Pera MC a kol. (Duben 2019). „Aktualizace od SUNFISH, část 1: Bezpečnost, snášenlivost a PK / PD ze studie zaměřené na zjištění dávky, včetně údajů o průzkumné účinnosti u pacientů s spinální svalovou atrofií typu 2 nebo 3 (SMA) léčených risdiplamem (RG7916) (S25.007)“. Neurologie. 92 (15 dodatek). ISSN 0028-3878.
- ^ Inacio P (2018-12-21). „Risdiplam udělil PRIME označení EMA pro potenciál ve spinální svalové atrofii“. Novinky SMA dnes. Citováno 8. srpna 2020.
- ^ „Označení PRIME udělené Evropskou agenturou pro léčivé přípravky pro risdiplam Roche pro léčbu spinální svalové atrofie (SMA)“. Roche (Tisková zpráva). 17. prosince 2018. Citováno 12. srpna 2020.
- ^ „EU / 3/19/2145“. Evropská agentura pro léčivé přípravky (EMA). 9. dubna 2019. Citováno 12. srpna 2020.
- ^ „PTC oznamuje přijetí evropské žádosti o registraci přípravku Evrysdi (risdiplam) pro léčbu spinální svalové atrofie“. PTC Therapeutics, Inc.. Citováno 2020-08-18.
- ^ Světová zdravotnická organizace (2018). "Mezinárodní nechráněné názvy farmaceutických látek (INN): doporučeno INN: seznam 80". WHO Informace o drogách. 32 (3): 482. hdl:10665/330907.
- ^ „Roche oznamuje globální program soucitného použití pro risdiplam“. Spinální svalová atrofie UK. Citováno 2020-04-08.
externí odkazy
- "Risdiplam". Informační portál o drogách. Americká národní lékařská knihovna.
- Číslo klinického hodnocení NCT02913482 pro „Vyšetřujte bezpečnost, snášenlivost, PK, PD a účinnost risdiplamu (RO7034067) u kojenců se spinální svalovou atrofií typu 1 (FIREFISH)“ na ClinicalTrials.gov
- Číslo klinického hodnocení NCT02908685 pro „Studie zkoumající bezpečnost, snášenlivost, farmakokinetiku, farmakodynamiku a účinnost risdiplamu (RO7034067) u účastníků spinální svalové atrofie typu 2 a 3 (SMA) (SUNFISH)“ na ClinicalTrials.gov
